稳定报告基因细胞系如何将信号通路活动转化为可量化的实验读出?本文从科研技术角度系统梳理稳定报告细胞系的基本原理、常用宿主(HEK293、CHO)、基因递送与筛选术语(lentivirus、puromycin、hygromycin B、Geneticin (G418)、blasticidin),以及 qPCR、Western blot、flow cytometry、ELISA 等验证手段在报告体系中的作用,帮助读者建立对稳定报告细胞系的整体认识。
1. 稳定报告基因细胞系的基本概念
稳定报告基因细胞系是一类通过稳定整合报告基因表达盒,使细胞在长期培养和多代传代过程中持续输出可检测信号的工程化细胞模型。与瞬时转染报告实验不同,稳定报告系统并不依赖短期、高拷贝表达,而是依托基因组整合后的持续转录与表达,使报告信号成为细胞内生物学事件的长期"替代读出"。
在科研实践中,报告基因通常用于将复杂、难以直接测量的分子事件转化为可量化信号,例如转录因子活化、受体信号转导或通路级调控变化。稳定报告细胞系的核心价值在于,其信号输出不再受到转染效率波动或表达衰减的显著影响,从而为实验重复性和跨批次比较提供更可靠的基础。
2. HEK293 与 CHO 宿主在报告体系中的适配性
宿主细胞背景是决定报告系统行为的重要因素。HEK293 与 CHO 是当前最常用的两类哺乳动物宿主,在稳定报告细胞系构建中各具代表性。
HEK293 细胞具有较高的基因递送适配性,对多种调控元件和报告系统响应灵敏,因此常被用于转录调控、信号转导及受体相关通路的报告研究。其人源背景使得部分信号节点的调控特征更接近真实生物学状态,有利于机制层面的解析。
CHO 细胞则以培养适应性和长期稳定性见长,在报告体系中常用于强调群体稳定性、长期实验一致性或与分泌通路相关的信号读出。宿主选择并非单纯的技术偏好,而是将通路特征、信号强度需求与实验读出方式进行匹配的过程。
3. 基因递送、整合与筛选术语的理解
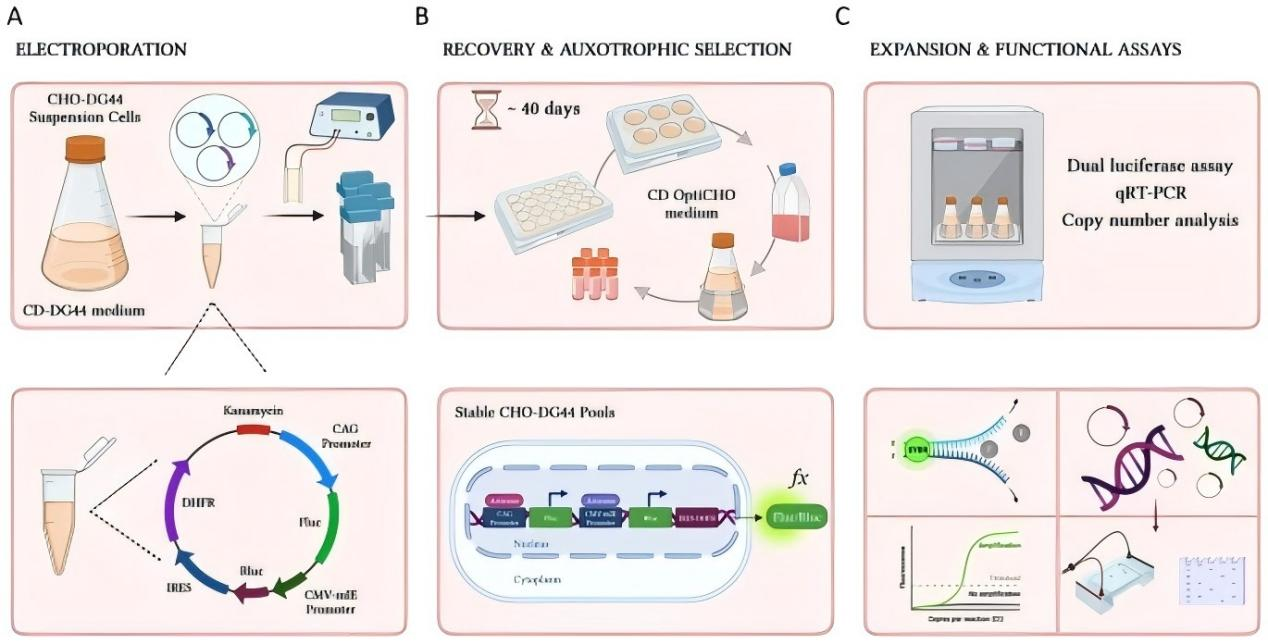
稳定报告细胞系的建立依赖外源报告表达盒在宿主基因组中的长期保留。除非病毒递送方式外,lentivirus 因其在多种细胞类型中具有较高转导效率并支持基因组整合,常用于难转染或特定背景细胞的报告系统构建。
在获得报告阳性细胞的过程中,选择压力是不可或缺的步骤。常见抗性筛选试剂包括 puromycin、Geneticin (G418)、hygromycin B 与 blasticidin。puromycin 作用迅速,适合需要快速建立稳定群体的体系;G418 筛选过程相对温和;hygromycin B 与 blasticidin 常用于多重工程或已有抗性背景的系统中。筛选的目标并非追求极限压力,而是在清除阴性细胞的同时,维持报告阳性细胞的生理稳定性。
4. 稳定报告细胞池与单克隆的信号特征差异
稳定报告细胞系通常以多克隆混合池或单克隆两种形式存在。多克隆细胞池由多个独立整合事件的细胞组成,其优势在于建立速度快,群体平均信号对个别整合位点效应不敏感,适合用于初步通路验证或筛选应用。
单克隆报告细胞系则来源于单一细胞扩增,整合位点与拷贝数相对一致,信号分布更集中。对于需要严格对照、精细动力学分析或强调长期一致性的实验体系,单克隆往往能够提供更清晰、可比的信号基线。二者的选择本质上反映了对"群体平均稳定"或"来源一致稳定"的不同需求取向。
5. 多维验证在报告信号确认中的作用
稳定报告细胞系建立后,需要通过多层次的验证手段界定其信号属性。转录层面,qPCR 可用于确认报告基因转录是否稳定存在,并评估不同代次间的表达一致性。蛋白层面,Western blot 有助于确认报告蛋白的分子量与完整性,排除异常降解或非特异表达。
在群体层面,flow cytometry 不仅能够量化平均信号强度,还可通过分布形态判断群体是否均一,从而识别潜在的不稳定亚群。对于分泌型或上清相关的报告读出,ELISA 可提供定量信号,支持不同条件或刺激下的比较分析。上述 qPCR、Western blot、flow cytometry 与 ELISA 共同构成对稳定报告体系的正交验证框架。
6. 总结
稳定报告基因细胞系是一种将信号通路活动转化为长期、可重复实验读出的细胞工程工具。HEK293 与 CHO 宿主背景、lentivirus 等递送框架、抗性筛选策略以及多克隆与单克隆形态,共同决定了报告系统的行为特征。通过 qPCR、Western blot、flow cytometry 与 ELISA 等多维验证手段,报告信号从概念层面转化为可被定义和复核的数据属性,为细胞水平功能研究提供稳定而清晰的实验基线。