前言
为什么某些配合物稳定,而另一些却极易分解?为什么有机反应中电子丰富的烯烃对不同亲电试剂的反应性差异如此之大?传统的 Brønsted 酸碱理论和 Lewis 酸碱理论虽然为我们提供了化学反应的基本框架,但仍不足以解释许多键合偏好与反应选择性。为此,Pearson于1963 年提出了软硬酸碱理论(HSAB),以一种更接近"电子结构直觉"的方式描述酸与碱的匹配规律。
本文将以通俗的方式带你系统理解 HSAB 的核心思想,并展示它如何帮助我们解释物质稳定性、预测反应方向、设计催化体系。
一、 什么是软硬酸碱理论?
HSAB 理论从 Lewis 酸碱理论出发,根据粒子的电子结构特征,将酸和碱划分为:
- 硬酸(Hard Acid)
- 软酸(Soft Acid)
- 硬碱(Hard Base)
- 软碱(Soft Base)
它提出了一个极其重要的规律:
硬酸喜欢硬碱,软酸喜欢软碱,中间类型彼此匹配。
这种"默契"反映了电子云分布、可极化性、轨道能量匹配等深层因素。
- 硬酸/硬碱的特征
- 半径小
- 电荷大
- 可极化性低
- 电荷集中、电子云刚性强
- 对应:F⁻、OH⁻、O²⁻、Al³⁺、Mg²⁺等
- 软酸/软碱的特征
- 半径大
- 可极化性高
- 电子云柔软、易变形
- 对应:I⁻、S²⁻、Ag⁺、Hg²⁺、Pt²⁺、烯烃、芳香环等
这些差异构成了"硬亲硬、软亲软"的基础。
二、 软硬酸碱的"计算基础":硬度、软度与前线轨道
为了让 HSAB 不再停留在定性经验,Parr 和 Pearson 在密度泛函理论(DFT)框架下进一步提出了绝对化学硬度(η)与软度(S)。
- 化学硬度(η)
- I:电离能
- A:电子亲和能
- η 越大 → 越"硬"
- η 越小 → 越"软"
- 化学软度(S)
软度高表示体系更容易被极化,电子云更加"柔软"。
- 局部软度与 Fukui 函数
为了预测分子哪个位置最"软",提出了:
- f(r):Fukui 函数
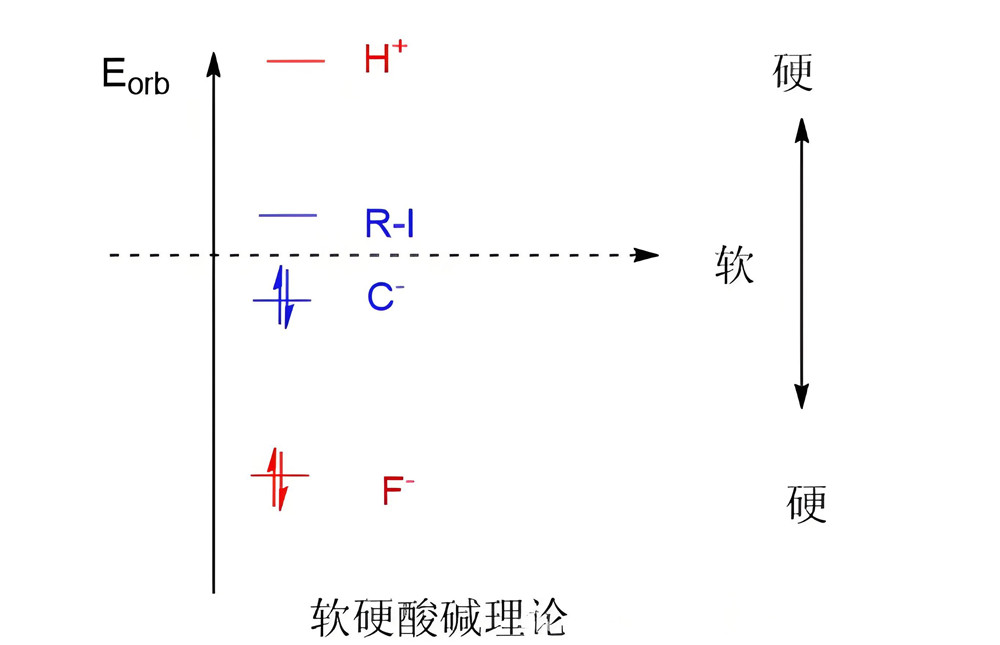
常用于预测亲电或亲核攻击的位点,是现代有机/配位反应机理分析的重要工具。 - 轨道观点(Klopman 模型)
- 硬-硬:电荷控制(Coulomb 主导) → 离子键
- 软-软:前线轨道控制(HOMO-LUMO 匹配良好) → 共价键
这为 HSAB 赋予了量子化学基础。
三、 HSAB 理论 的作用
HSAB 理论的力量在于它能以极简的规则解释大量化学现象。
- 预测配合物的稳定性
例如:
|----------|--------|------------|
| 金属离子 | 配体 | 解释 |
| Ag⁺(软酸) | I⁻(软碱) | 极稳定(如 AgI) |
| Ag⁺ | F⁻(硬碱) | 不稳定 |
| Al³⁺(硬酸) | F⁻(硬碱) | 非常稳定 |
| Al³⁺ | I⁻(软碱) | 不稳定 |
金属硫配体、氰配体体系也遵循同样规律。
- 有机反应选择性预测
- 亲电试剂软度大小会导致对烯烃/芳环反应性的显著差异
- 解释 SN1 / SN2 途径偏好
- 解释金属催化反应中特定配体的选择性
- 矿物与材料的组成
- 硬酸硬碱矿物 → 氧化物(如 MgO、Al₂O₃)
- 软酸软碱矿物 → 硫化物(如 HgS、CuS)
这解释了自然界矿物分布规律。
- 离子极化与结构趋势
软度越大 → 越容易被外场扭曲电子云
例如:
- I⁻、S²⁻ 极化性极强 → 典型软碱
- F⁻ 极化性弱 → 最硬的碱之一
这些规律可用于判断晶体结构、推断键型。
四、 HSAB 理论的不足与注意事项
尽管 HSAB 容易使用、适用面广,但它也不是"万能钥匙":
-
- 不能精确给出反应速率
它预测的是趋势,而非动力学。
-
- 多位点反应体系可能偏离预测
例如某些多功能化有机分子,其实际反应位点还受:
- 溶剂效应
- 空间位阻
- 动力学路径的影响。
-
- 化学硬度的理论基础仍存在争议
在真实原子中电子数是离散的,但硬度的定义依赖连续可微模型,这在理论化学中存在讨论。
即便如此,HSAB 仍然是化学中最强大的工具之一。
五、 总结
软硬酸碱理论是一条朴素却极具洞察力的化学规律,它从电子结构的角度解释了酸碱反应的偏好性:
- 硬酸硬碱 → 离子键为主 → 稳定
- 软酸软碱 → 共价键为主 → 稳定
- 软硬组合 → 不利
从配合物稳定性、有机反应选择性,到矿物组成和材料化学,HSAB 理论都提供了高度概括性的化学直觉。尽管它并非严格的量子化学理论,但它的预测力与解释力,使其成为理解化学世界的一把关键钥匙。