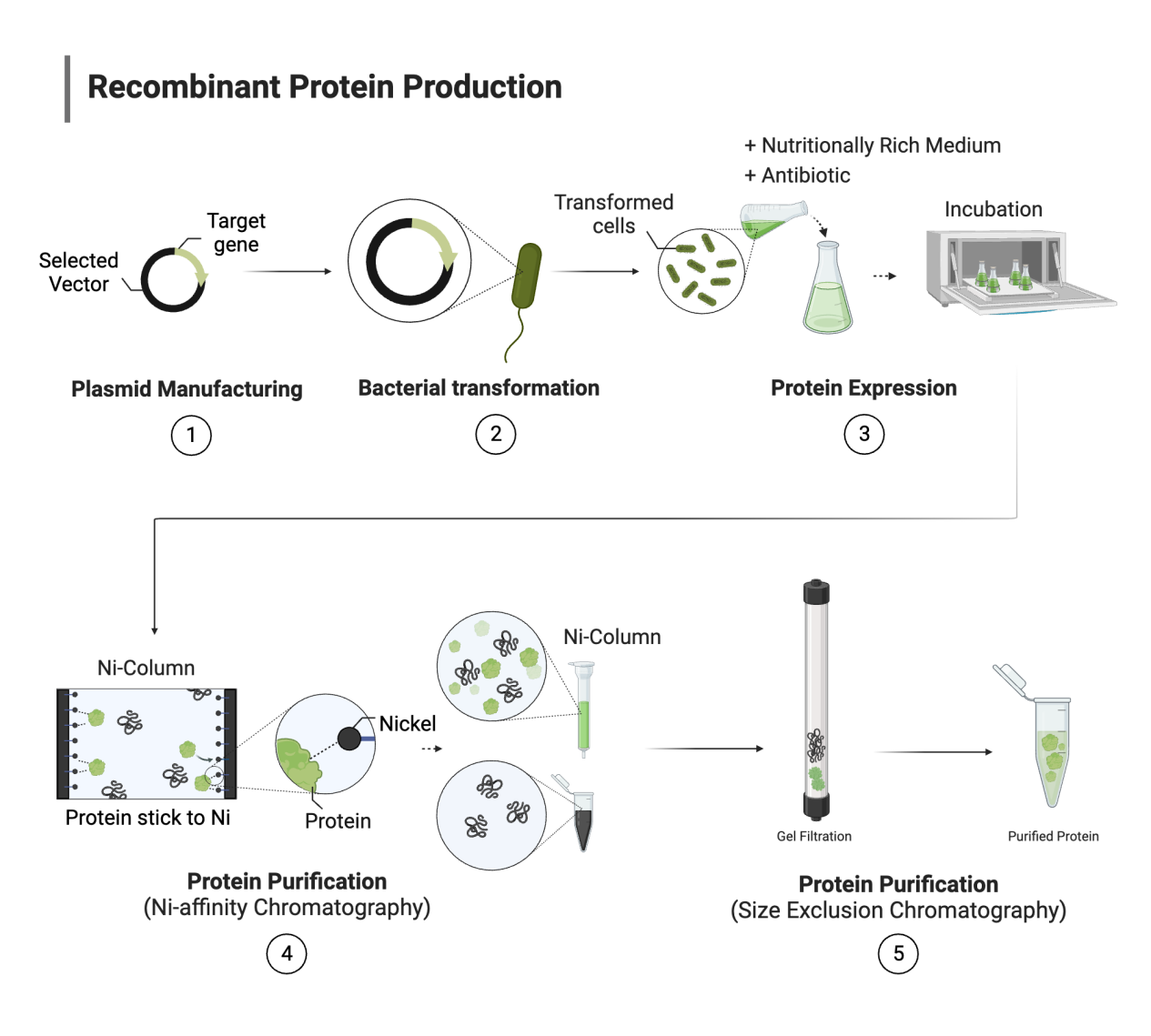
在生命科学研究中,蛋白质是执行生物功能的核心分子,而重组蛋白则是科研中最常见、最标准化的蛋白来源之一。所谓重组蛋白,是指通过基因工程手段,将编码目标蛋白的基因导入异源宿主细胞中,由宿主的生物合成体系表达并获得的外源蛋白。与天然提取蛋白相比,重组蛋白的遗传背景清晰、组成一致性高,能够满足科研实验对可重复性和可控性的基本要求。
从技术层面看,重组蛋白并不是单一"表达结果",而是一个从遗传信息到分子结构逐级实现的过程。这一过程涵盖了基因克隆、转录与翻译、蛋白折叠以及结构与功能形成等多个关键环节。
一、从基因到表达模板:重组蛋白的遗传基础
重组蛋白技术的起点是目标蛋白编码基因的获取与设计。蛋白质的一级结构由其氨基酸序列决定,而这一序列在遗传层面对应特定的开放阅读框。为了实现外源表达,该编码序列需要以DNA形式被构建到表达载体中,并能够被宿主细胞正确识别和读取。
在实际操作中,目标基因通常以cDNA形式使用,以避免内含子在异源系统中无法被正确剪接的问题。同时,为了提高翻译效率和表达稳定性,基因序列往往会根据宿主的密码子偏好进行适当调整。在不改变氨基酸序列的前提下,这种设计有助于提高外源基因在宿主中的适配性。
表达载体是连接目标基因与宿主细胞之间的关键媒介。一个完整的表达载体通常包含启动子、目标基因序列、转录终止信号以及筛选标记等元件。其中,启动子决定了外源基因是否以及在何种条件下被转录,是调控表达行为的核心因素。当表达载体成功导入宿主细胞后,目标基因便成为宿主遗传体系中的一部分,具备被表达的基础条件。
二、外源蛋白的合成:转录、翻译与初级结构形成
在宿主细胞内,重组蛋白的合成遵循生物学中心法则。首先,表达载体上的启动子被宿主的转录系统识别,RNA聚合酶以DNA为模板合成信使RNA。这一转录过程决定了外源基因信息能否被有效传递,是蛋白表达的第一道分子关卡。
生成的mRNA随后进入翻译阶段。核糖体沿着mRNA序列逐个读取密码子,并在转运RNA的协助下,将对应的氨基酸连接成多肽链。此时形成的是一条线性的氨基酸序列,也就是蛋白质的一级结构。需要强调的是,翻译完成并不等同于获得具有生物学功能的蛋白,这一阶段仅仅完成了"序列层面"的合成。
翻译效率与准确性受到宿主翻译体系、mRNA稳定性以及起始信号等多种因素影响。不同表达系统在这一层面存在固有差异,但其本质都是利用宿主自身的核糖体和相关因子完成外源蛋白的合成。
三、蛋白折叠与结构建立:从多肽到三维构象
蛋白质的功能高度依赖其空间结构。翻译完成的新生多肽链在细胞内需要进一步折叠,形成稳定的二级、三级乃至四级结构。折叠过程主要由氨基酸之间的相互作用驱动,同时在许多情况下依赖分子伴侣的协助,以避免错误折叠或非特异性聚集。
正确折叠的蛋白通常具有明确的空间构象和功能位点,而折叠异常则可能导致蛋白不溶、结构不稳定或完全失去活性。因此,蛋白折叠被认为是决定重组蛋白质量的关键分子事件之一。
对于部分蛋白而言,结构的完善还需要经历翻译后的化学修饰过程。常见的后翻译修饰包括糖基化、磷酸化等,这些修饰并不改变蛋白的一级结构,但会显著影响其构象稳定性、分子识别能力以及功能状态。由于不同生物系统在后翻译修饰机制上的差异,表达宿主的选择直接影响重组蛋白的最终结构特征。
四、功能蛋白的形成:结构与活性的统一
当蛋白完成折叠并具备必要的结构修饰后,才有可能成为真正意义上的功能蛋白。所谓功能蛋白,并不仅仅指序列正确的蛋白分子,而是指在体外实验条件下能够保持稳定结构,并表现出与其生物学定义一致的分子行为。
这种功能表现可以是酶催化活性、特定分子之间的结合能力,也可以是参与信号识别或结构支撑等作用。从分子角度看,蛋白功能来源于其精确的三维构象以及由此形成的动态结构特性。即便氨基酸序列完全一致,如果空间结构发生偏差,蛋白也可能无法正常发挥功能。
在科研应用中,重组蛋白正是以这种"结构明确、性质可控的功能分子"形式存在,为体外实验提供稳定可靠的研究对象。
五、技术视角下的重组蛋白概念总结
总体而言,重组蛋白是基因工程与蛋白生物学相结合的产物,其本质是通过异源表达系统重建蛋白从遗传信息到功能分子的完整路径。这一过程不仅涉及基因层面的设计与表达,还依赖宿主细胞在转录、翻译、折叠和修饰等多个层面的协同作用。
从科研试剂角度理解重组蛋白,有助于研究人员在实验设计和结果解读时,更清楚地认识蛋白样品的来源、结构基础及其潜在特性。这种分子层面的技术认知,是合理使用重组蛋白开展基础研究的重要前提。
参考文献
Smith, J. A. et al. Advances in recombinant protein design and expression. Nat. Rev. Mol. Cell Biol. 24, 123--140 (2023).
Li, X. Q. et al. Molecular chaperones and protein folding in heterologous expression. Nat. Rev. Biotechnol. 42, 456--470 (2024).
Kim, S. H. et al. Translational regulation in recombinant protein expression. Nat. Biotechnol. 41, 85--99 (2023).
Gupta, A. & Singh, N. Post-translational modifications and protein function. Nat. Struct. Mol. Biol. 30, 533--545 (2023).
Zhang, Y. J. et al. Comparative expression systems for recombinant proteins. Nat. Biotechnol. 44, 112--125 (2025).