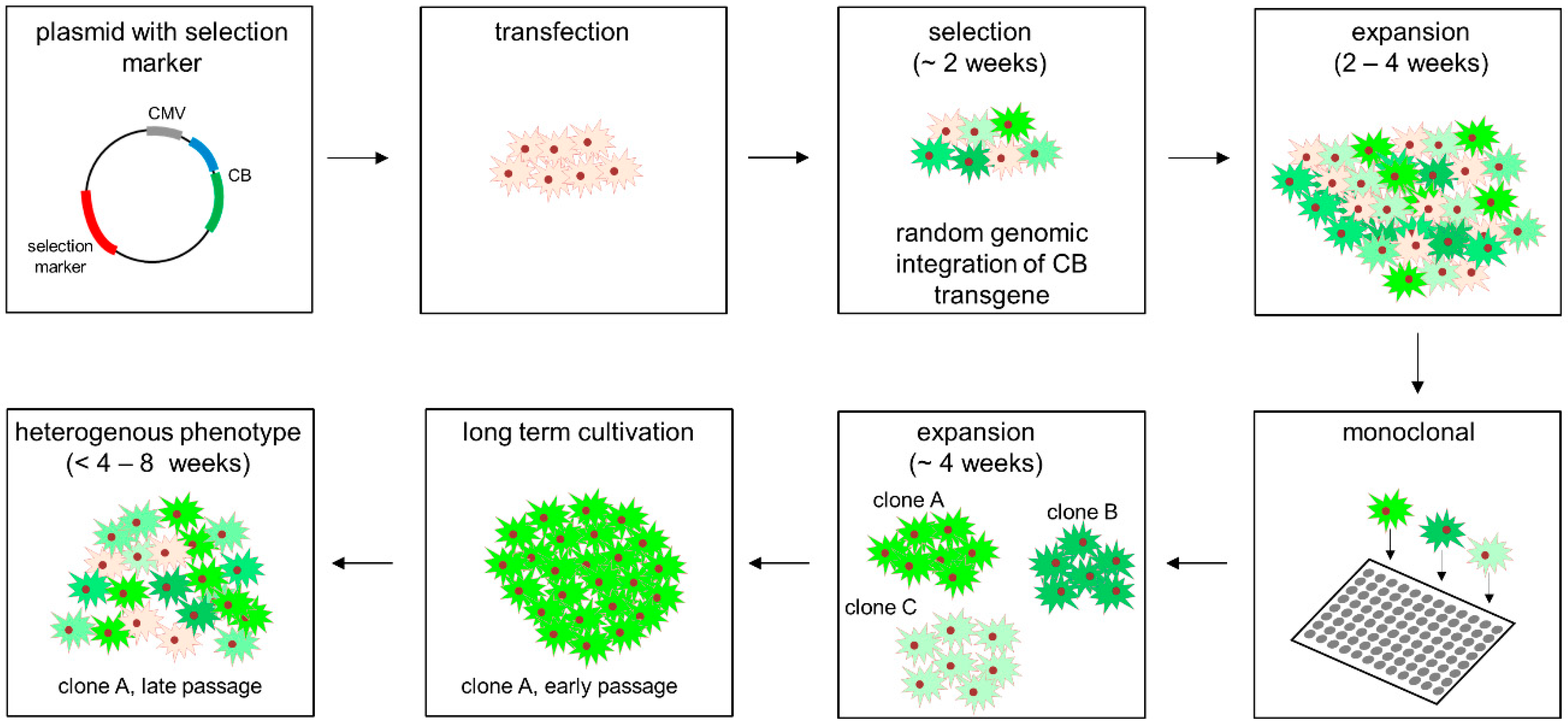
在现代生物制药和分子生物学研究中,稳定细胞系是实现可重复、高产蛋白表达的基础。它不仅用于抗体和疫苗的研发,还广泛应用于酶学研究、信号通路分析和基因功能验证。
一、稳定细胞系的基本原理
稳定细胞系的核心是基因的基因组整合:
基因组整合
目标基因通过各种方法插入宿主细胞的染色体中,而不是停留在细胞质内(如瞬时转染)。
这种整合可以是随机的,也可以是位点特异性的(如 CRISPR/Cas9 或 Flp-In 系统)。
克隆选择
一个宿主细胞在整合目标基因后会衍生出整个细胞群体(克隆)。
通过筛选和单克隆分离,可以获得稳定、高表达的克隆,保证蛋白产量和一致性。
长期表达与遗传稳定性
成功整合的基因在多代传代中仍能持续表达。
避免了瞬时转染中蛋白表达随时间衰减的问题。
二、稳定细胞系构建的流程
稳定细胞系的开发一般包括以下几个核心环节:
1. 设计与载体构建
目标基因优化:提高翻译效率,添加信号肽和标签。
表达载体选择:包含启动子、增强子、筛选标记(如嘌呤霉素或潮霉素)和复制元件。
宿主细胞匹配:根据蛋白特性选择 CHO、HEK293 或其他专用细胞系。
2. 基因递送与整合
转染/转导方法:
化学转染:适用于多数易转染细胞
电穿孔:适合难转染或悬浮细胞
病毒载体(慢病毒、腺病毒等):高效率,适合非分裂细胞
整合方式:
随机整合:快速,但表达水平受染色体位置影响
位点特异性整合:在"安全位点"插入,表达更可预测
3. 初步筛选与扩增
抗性筛选:使用药物选择只保留成功整合目标基因的细胞。
初步表达评估:通过荧光、酶活性或免疫检测确认蛋白表达。
4. 单克隆分离
目的:确保每个克隆来源于单一细胞,避免混合遗传背景。
方法:
极限稀释法
流式细胞分选(FACS)
克隆成像系统(如 CloneSelect)
5. 克隆表征与稳定性验证
表达量测定:ELISA、Western blot 或荧光定量
长期传代测试:在无选择压力下持续多代传代,观察表达水平变化
功能验证:确保蛋白结构正确、功能活性保持
6. 细胞库建设
主细胞库(MCB):长期保存,作为原始克隆来源
工作细胞库(WCB):用于实验或生产放大
质量检测:STR 鉴定、无菌、支原体及病毒检测
稳定细胞系构建是一个"设计 → 整合 → 筛选 → 验证 → 库存"的循环工程。每一步都涉及分子生物学、细胞培养和工程技术的交叉应用。通过标准化的流程和严谨的技术控制,稳定细胞系能够为研究和产业化提供可靠、可重复、长期稳定的蛋白生产平台。