2023年6月,美国国立心肺血液研究所的研究团队在Nature Communications 上发表题为"Signaling mechanisms in renal compensatory hypertrophy revealed by multi-omics"的文章,该研究通过在单侧肾切除的小鼠模型中使用多组学方法(蛋白质组学、RNA-seq 和ATAC-seq等)识别肾近端小管中与代偿性肥大相关的信号传导过程,证明脂质激活转录因子 PPARα 是近端小管代偿性肥大的重要决定因素,对肾脏代偿性肥大的机制有了更好的理解。
研究背景
肾脏有明显的代偿肥大能力,当在肾移植、肾外伤或肾癌中切除单个肾时,对侧肾的大小和功能增加,导致功能代偿(代偿性肥大),肥大发生在单个肾小管(肾单位)的水平上。在肾脏代偿性增加之前,会有血流动力学的变化,然而目前尚不清楚转化为细胞反应的关键信号与肾小管中的流量或压力增加有关,还是与循环因子有关。另外,肾单位是通过增加细胞大小(细胞肥大),还是增加细胞数量(细胞增生)或两者兼而有之来增加其大小目前尚未可知,由于参与细胞生长和细胞增殖的信号机制不同,因此,至今仍不能较为全面地认识和阐释此过程。
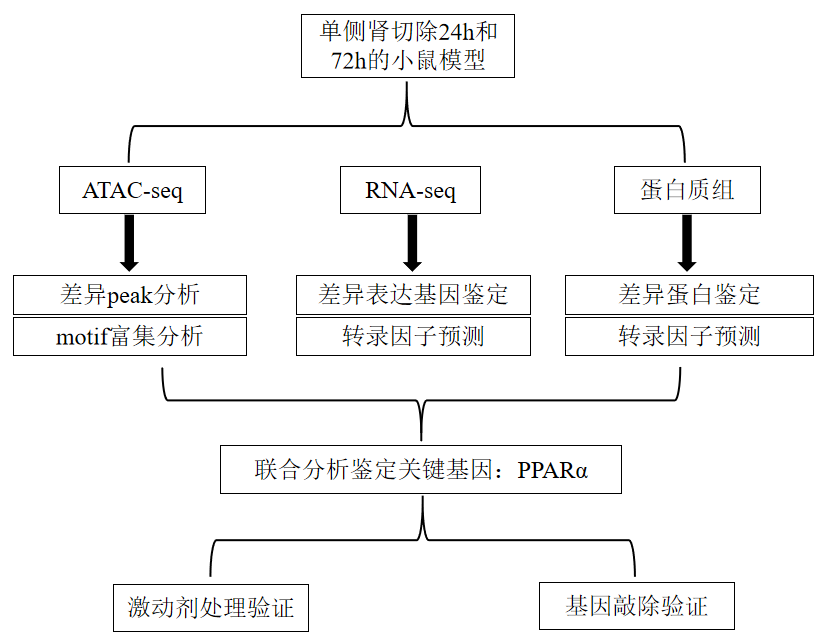
研究思路
研究结果
1. 单侧肾切除术(UNX)后的代偿性肥大发生迅速,主要是由于近端小管中细胞体积的增加。
在雄性小鼠单肾切除(UNX)后的24小时和72小时分别对侧肾进行观察(图1.A)。肾脏重量与体重比(KW:BW)显示对侧肾脏快速生长,在第3天时比值最大(图1.B),表明触发肥大的相关基因表达变化可能发生在前3天。肾脏切片的组织学显示单侧肾切除后第3天,肾皮质厚度增加,肾脏冠状面长度增加(图1.C、D)。免疫荧光图像显示,近端小管的细胞体积显著增加,但细胞数量没有明显变化;而皮质集合管的细胞体积和细胞数量均显著增加(图1.E、F)。这些结果表明单侧肾切除术后的代偿性肥大发生迅速,不仅发生在近端小管也在集合管,近端小管直径的增加发生很大程度上是由于细胞体积的增加 。
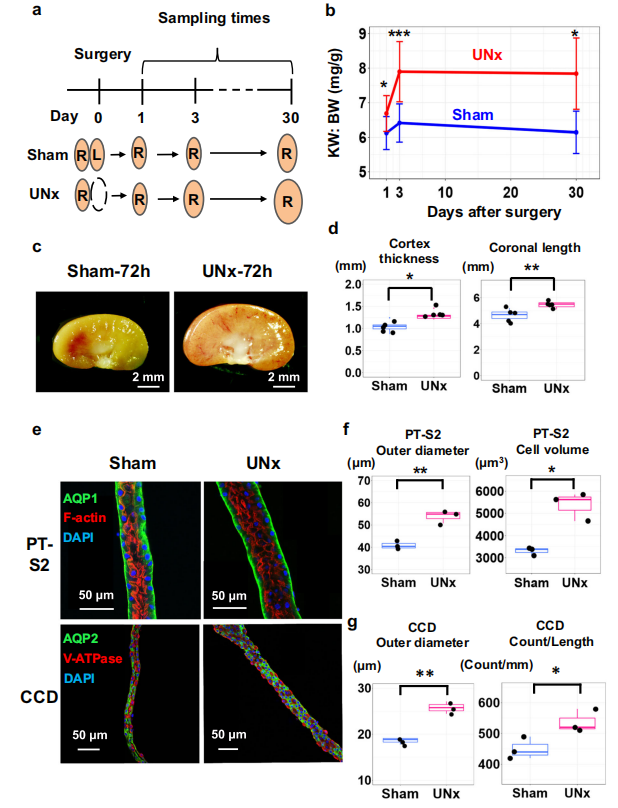
图1.单侧肾切除术(UNx)后的代偿性肥大发生迅速,主要是由于近端小管中细胞体积的增加。
2. 单侧肾切除后24h近端小管的ATAC-seq
接下来作者在单侧肾切除后24小时,通过ATAC-seq分析S1近端小管的染色质可及性。UNx与对照组相比有4223个(3.4%)peak发生显著改变(图2.A)。为了研究特定的转录因子通路是否与UNx样本中染色质可及性的增加有关,作者对UNx中染色质可及性显著增加的peak进行了motif富集分析,显著富集的是肝细胞核因子-4(HNF4α)和过氧化物酶体增殖物激活受体(PPARα)对应的结合位点基序,它们是两种脂质调节的转录因子(图2.B、C)。对PPARα进行转录因子足迹分析,显示UNx样本中PPARα基序周围的染色质可及性增加(图2.D、E),PPARα和HNF4α靶基因的可及性在UNx组中显著上调(图2.F、G)。这些数据表明,UNx处理后PPARα结合基序的占据率升高,提示PPARα途径在UNx反应中发挥作用。
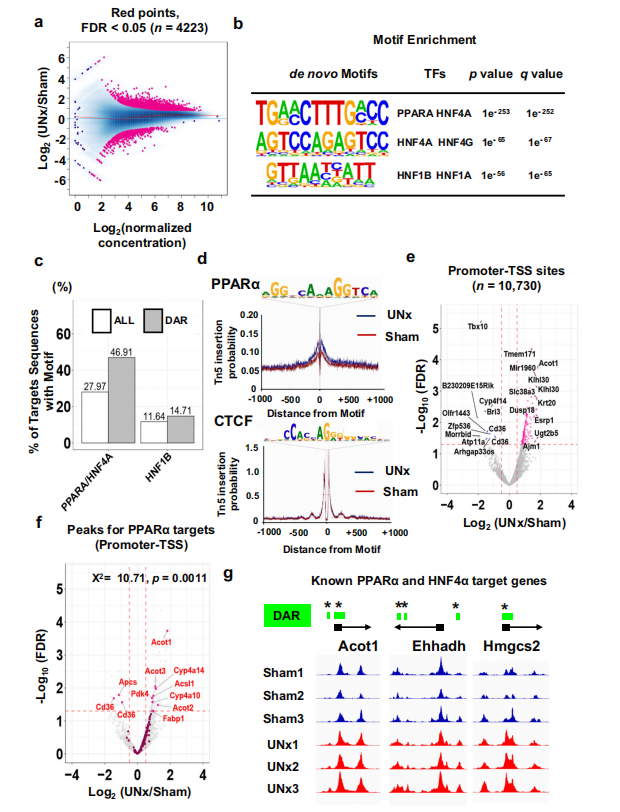
图2.单侧肾切除后24h近端小管的ATAC-seq
3. 单侧肾切除后24h近端小管的RNA-seq
接下来,作者对术后24小时的S1近端小管进行了RNA-seq,探究HNF4α和PPARα靶基因的表达变化。与对照组相比,UNX组中有215个基因表达显著增加,95个基因表达减少(图3.A),基因富集分析(GSEA)结果显示脂肪酸代谢生物过程显著富集(图3.B),PPARα和HNF4α靶基因的表达量也显著增加(图3.C)。此外,IPA分析预测了PPARα、SREBF1和HNF4α等转录因子以及STK11和INSR等激酶的激活(图3.D),而且PPARα靶基因的ATAC-seq数据和RNA-seq数据显示出高度相关性(图3.E),但HNF4α的靶基因则未表现出相关性(图3.F),提示 UNx 后肾小管代偿性肥大期间 PPARα 在基因启动子处有转录激活作用 。
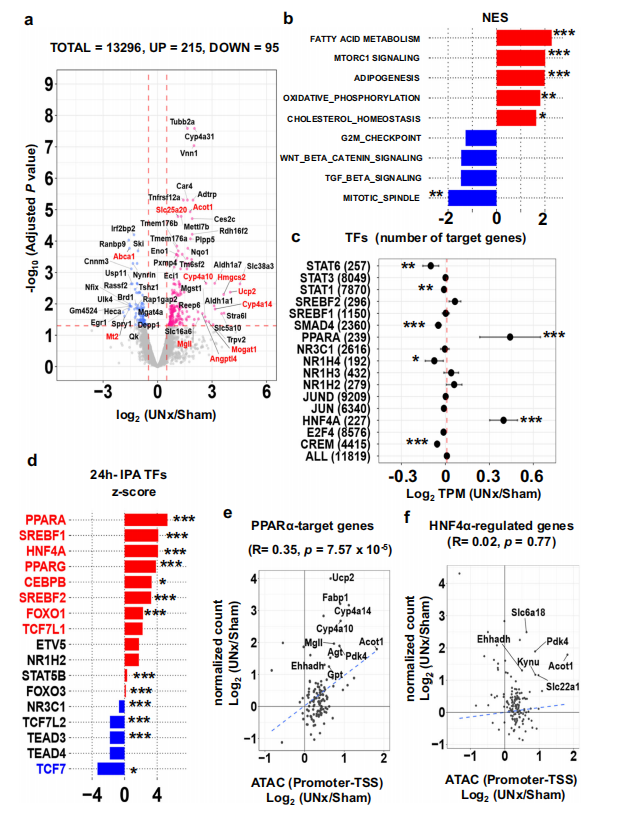
图3.单侧肾切除后24h近端小管的RNA-seq
4. 单侧肾切除后24h和72h集合管中的RNA-seq
接下来作者对皮质集合管进行了RNA-seq。术后24h的RNA-seq数据显示大量与细胞增殖相关的基因增加,包括E2F的靶基因(图4.A),GSEA分析表明与"E2F_TARGETS"、"G2M_CHECKPOINT"通路显著富集(图4.B),对72 h的RNA-seq数据进行GSEA富集分析,与24 h一致(图4.C),Ki-67标记在72 h的结合管细胞中显著增加(图4.D)。这些结果表明,在肾脏代偿性肥大过程中,皮质集合管发生了显著的增殖反应。
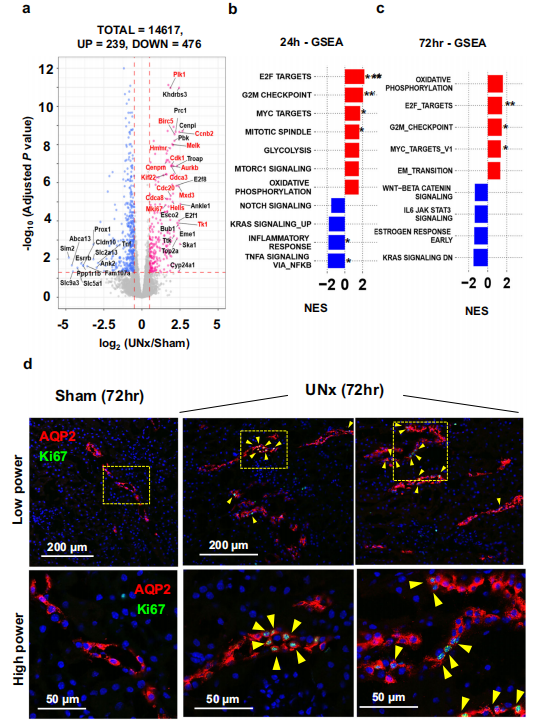
图4.单侧肾切除后24h和72h集合管的RNA-seq
5. 术后72 h近端小管的RNA-seq
接下来,作者又对72h的S1近端小管进行了RNA-seq(图5.A),与72h集合管的结果一致,"E2F_TARGETS"和"G2M_CHECKPOINT"两个通路显著富集(图5.B),E2F相关靶基因显著上调(图5.C),表明近端小管虽然无形态学上的增生表型,但是有增殖的趋势(图5.D)。PPARα靶基因在72h时表达变化已不再明显(图5.E),但IPA分析显示SREBF1、PPARα和HNF4α转录因子仍被激活(图5.F),这表明此时细胞受到的影响似乎已趋于稳定,而 PPARα 和 HNF4α 则一直是重要的调节因子 。
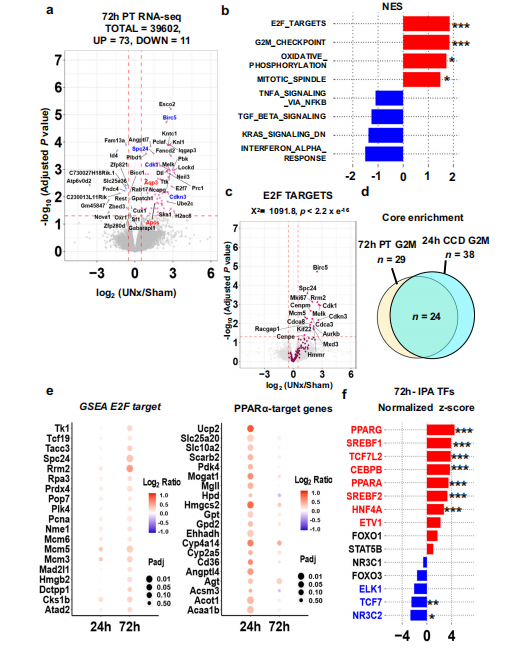
图5.单侧肾切除后72h近端小管的RNA-seq
6. 单侧肾切除术后24h的蛋白质组学
蛋白质组学对于验证转录组的结论合理解机制是必要的。接下来作者对单侧肾切除术后24h的肾脏进行了蛋白质组学分析,有128个蛋白上调,39个的蛋白下调(图6.A),PPARα的靶蛋白显著上调(图6.B),转录组和蛋白组进行联合分析,显示PPARα的靶基因有较强的相关性(图6.C、D),IPA分析表明PPARα是调控蛋白表达的前3个预测转录因子之一,而HNF4α则不是(图6.E),为了在近端小管中证实上述结果,作者对近端小管富集的肾皮质的样本进行了蛋白质组学研究(图6.F),IPA分析也显示PPARα转录因子被激活((图6.G)。
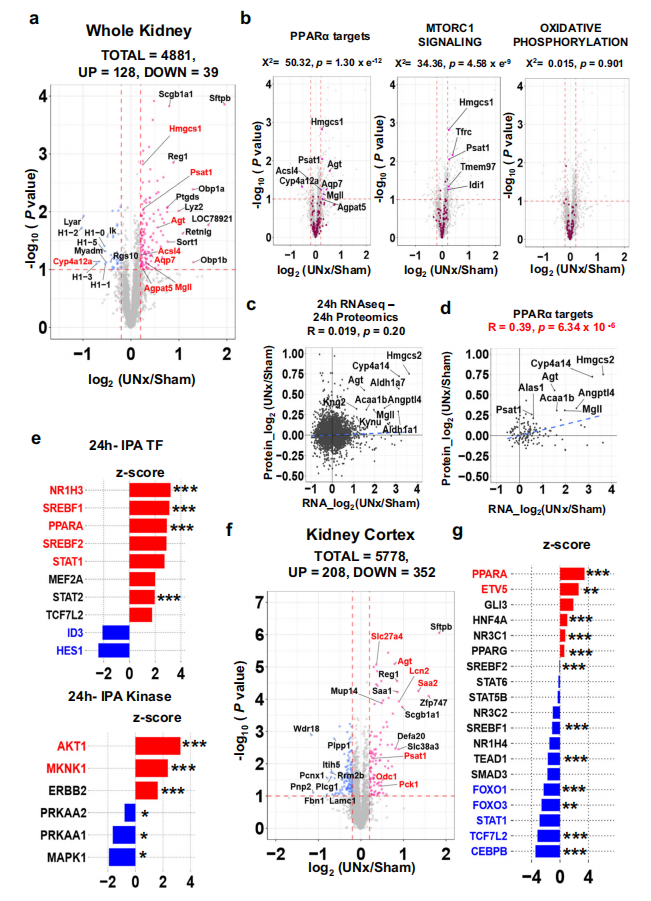
图6.单侧肾切除后24h肾脏的蛋白质组学
7. 单侧肾切除术后72h的蛋白质组学
术后72h的蛋白质组学结果(图7.A)显示,PPARα的靶蛋白和脂肪酸代谢通关的蛋白的变化已不再明显(图7.B、C),与RNA-seq结果一致,E2F的靶蛋白没有明显上调(图7.D),IPA分析结果显示转录因子PPARα和HNF4α以及AMPK激酶均被激活(图7.E)。
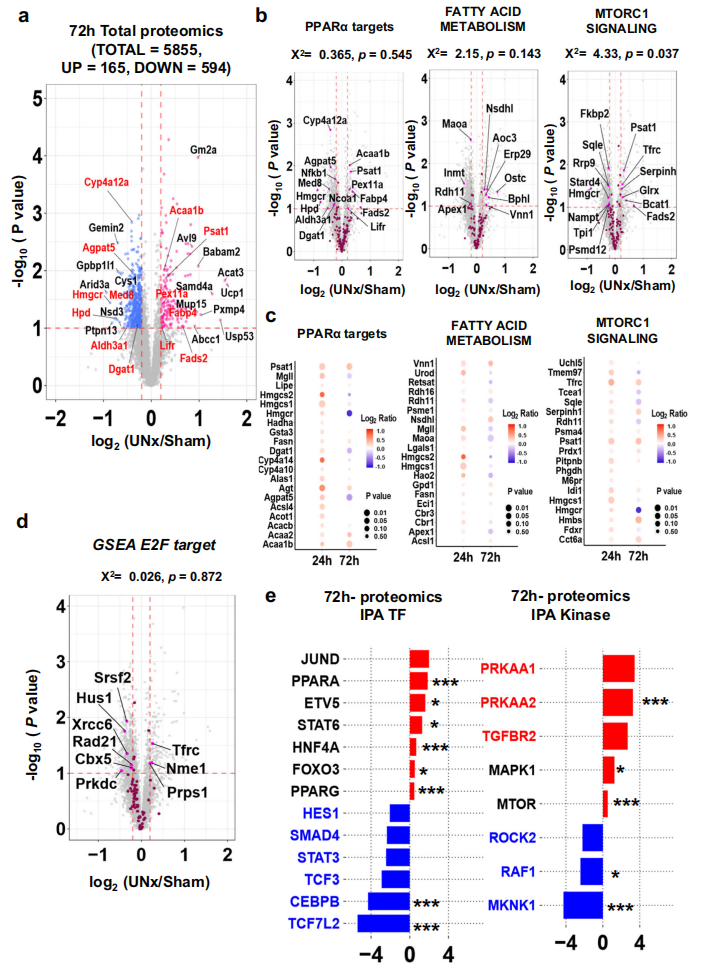
图7.单侧肾切除后72h肾脏的蛋白质组学
8. 多组学联合分析
接下来作者对ATAC-seq、RNA-seq和蛋白组的数据进行联合分析(图8.A),GO分析显示了脂肪酸代谢通路的显著变化(图8.B),PPARα内源性配体是饱和脂肪酸和不饱和脂肪酸或其衍生物,接下来使用气相色谱检测了肾脏中的脂肪酸水平,与对照组相比,UNX组中饱和脂肪酸和不饱和脂肪酸浓度显著升高(图8.C),另外小鼠肾脏脂质含量的定量分析显示,UNx组肾脏中甘油三酯和磷脂的浓度也显著增加,这与脂肪酸浓度增加一致(图8.D、E)。单侧肾切除后肾脏中内源性PPARα配体水平的显著增加,揭示了在这一背景下PPARα激活的潜在机制 。
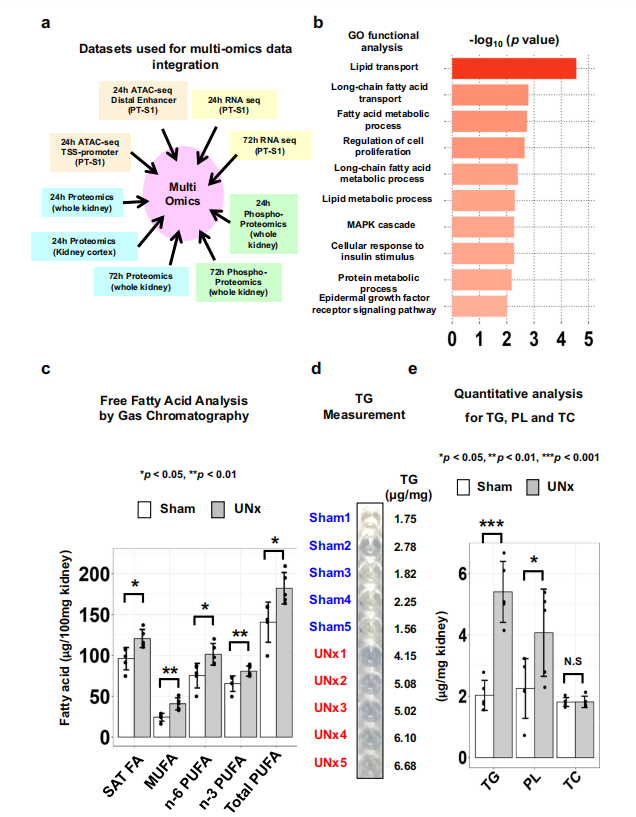
图8.多组学联合分析
9. PPARα可以调节近端肾小管中的细胞大小
为了进一步验证PPARα的激活或PPARα的缺失是否会影响细胞的大小,作者用PPARα的激动剂连续处理小鼠14天,PPARα的靶基因表达显著增加(图9.A),肾脏和体重比显著增加(图9.B),皮质厚度也显著增加(图9.C、D)。免疫荧光图片显示,近端小管的细胞体积变大(图9.E)。接下来作者又在小鼠中对PPARα进行基因敲除,在UNX 后24h,近端小管中显著上调的基因在PPARα缺失的小鼠中显著下调(图9.F、G),肾脏体重比和细胞体积在PPARα基因敲除的小鼠中均显著降低(图9.H、I)。这些表明PPARα是近端小管细胞大小的重要决定因素。
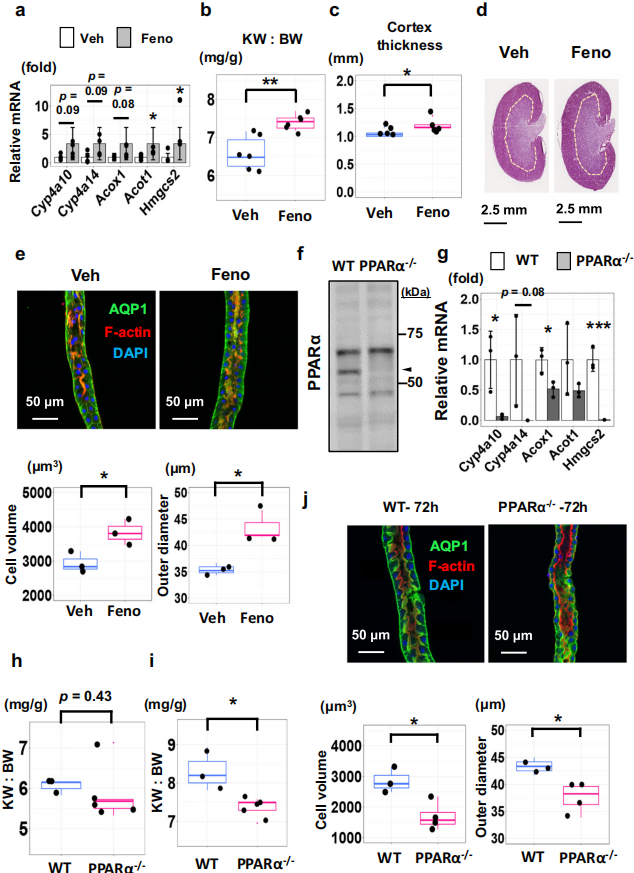
图9.PPARα可以调节近端肾小管中的细胞大小
研究结论
在这篇文章中,作者为了探究肾脏代偿性肥大的信号机制,构建了单侧肾切除的小鼠模型,通过三种不同的组学方法(ATAC-seq、RNA-seq 和蛋白质组学),鉴定了转录因子PPARα可能在肾脏代偿性肥大的过程中发挥重要的调节作用,肾脏中内源性PPARα配体水平的显著增加,可能是PPARα激活的潜在机制,接着通过在小鼠体内进行PPARα激动剂处理和基因敲除进行验证,证明了PPARα是近端小管细胞大小的重要调节因子。