COVID-19虽以呼吸系统感染为主,但对肺组织内免疫反应及细胞外基质(ECM)在疾病进展中的作用缺乏系统研究。多数研究集中于血液或支气管肺泡灌洗液样本,无法全面反映肺内空间免疫病理特征。此外,关于SARS-CoV-2感染的细胞类型、病毒微环境特征及胶原沉积的临床意义存在争议。近期,国际呼吸领域的权威期刊《Eur Respir J》(IF:21)发表了一项题为"Multi-omic spatial profiling reveals the unique SARS-CoV-2 lung microenvironment and collagen VI as a predictive biomarker in severe COVID-19"的论文。该研究通过P hen oCycler-Fusion ( PCF )空间单细胞蛋白组、GeoMX DSP空间转录组、多重免疫荧光和bulk转录组等多组学分析技术深入探索了重症COVID-19患者肺组织的免疫微环境及细胞外基质变化,并发现胶原蛋白VI(COL6)可作为预测疾病严重程度的生物标志物。
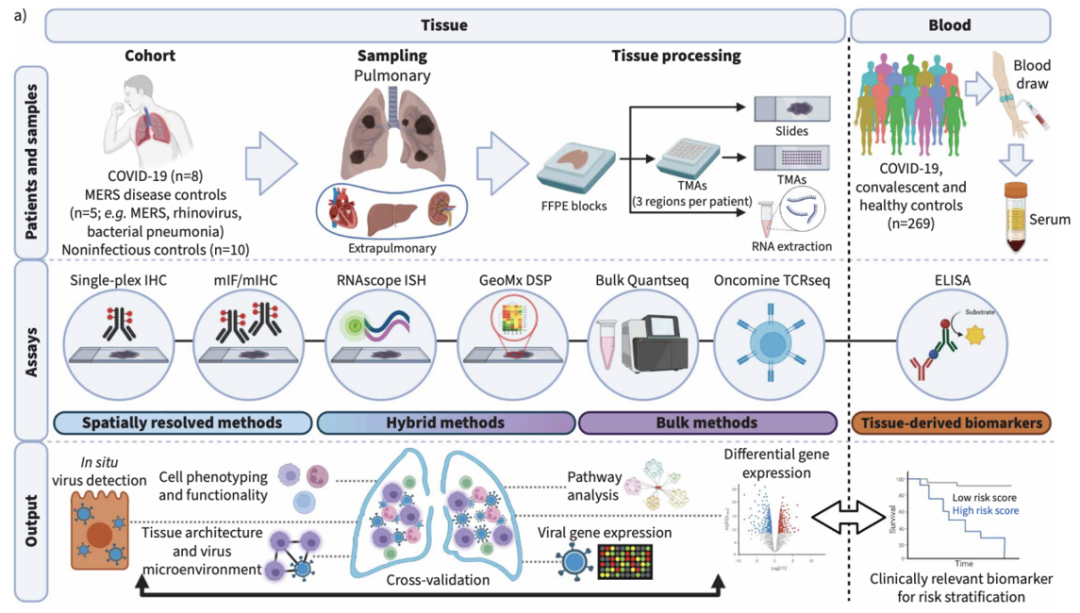
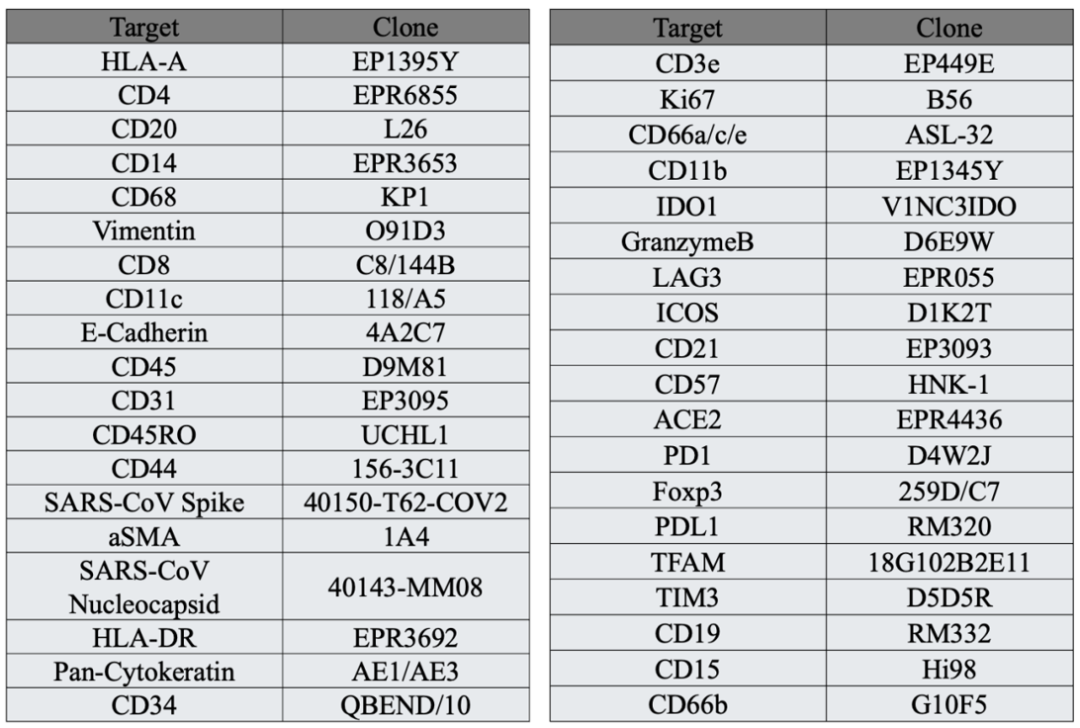
组织样本包括了8例COVID-19尸检肺组织(早期3例和晚期5例),以及8例对照样本(5例非呼吸道死亡、1例细菌性肺炎、1例鼻病毒肺炎和1例MERS肺炎)。研究对组织样本进行了空间转录组,以及PCF 空间单细胞蛋白组检测。PCF总共检测了38种抗体,包括了SARS-CoV-2蛋白Spike和Nucleocapsid的抗体。
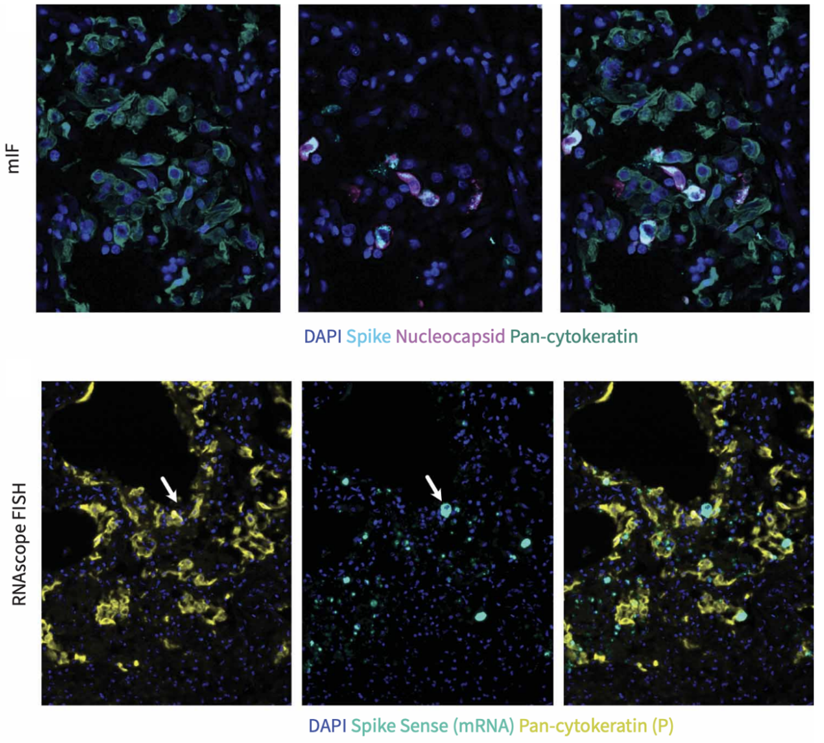
空间转录组发现了病毒RNA主要富集于肺泡区,血管区极少。PCF空间单细胞蛋白组和RNAscope确定了SARS-CoV-2阳性的细胞是Ⅱ型肺泡上皮细胞和少数巨噬细胞,并且仅限于早期病例。Bulk转录组也证实了晚期病例病毒载量显著下降。
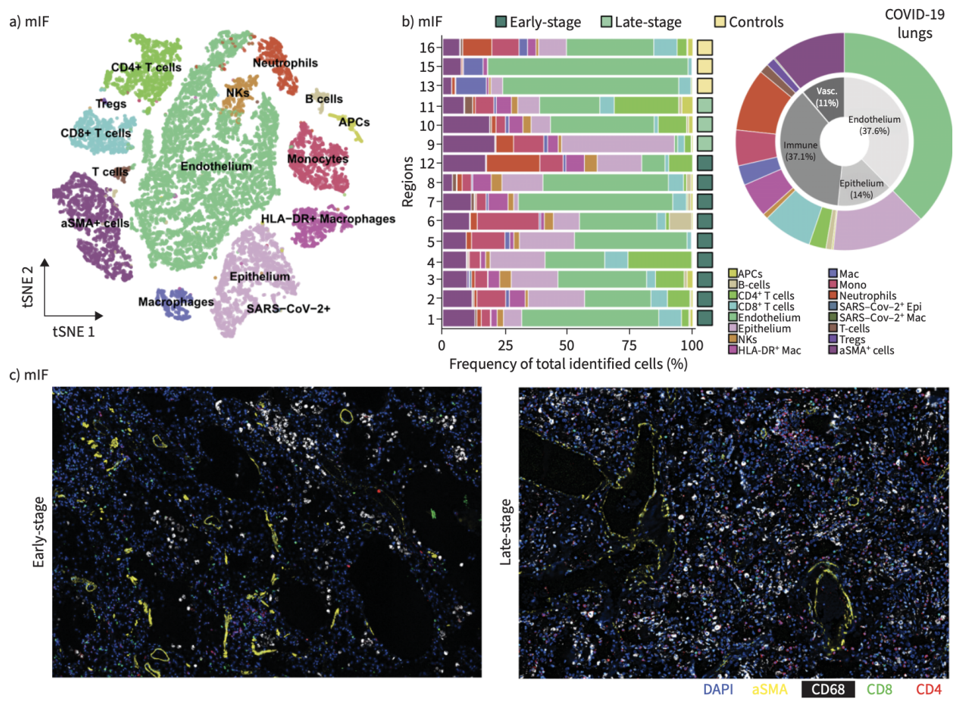
研究利用PCF空间单细胞蛋白组进行了免疫微环境解析。PCF分析了大约40多万个细胞,注释了多种免疫细胞、上皮细胞和间质细胞类型。研究发现了COVID-19肺内以巨噬细胞、中性粒细胞和T细胞为主,有较少的NK和B细胞,并且晚期病例免疫细胞浸润增加。
空间解析病毒感染和非感染上皮细胞的邻近细胞类型,结果发现了HLA-DR+ 巨噬细胞显著富集在病毒感染的上皮细胞附近,而CD4+和CD8+ T细胞在组织原位上逐渐远离病毒感染的上皮细胞。这些邻近的HLA-DR+ 巨噬细胞高表达免疫抑制分子PD-L1和IDO1。为了解释这种空间互作关系,研究者利用空间转录组分析了病毒RNA表达高和低的肺泡区域,结果发现了病毒RNA表达高的区域高表达很多趋化因子。这些趋化因子可能征募HLA-DR+ 巨噬细胞。
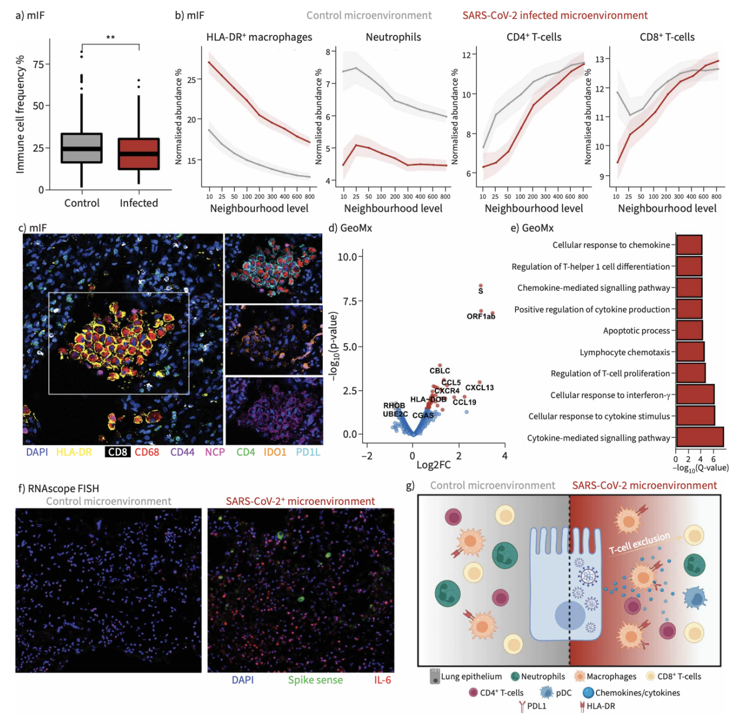
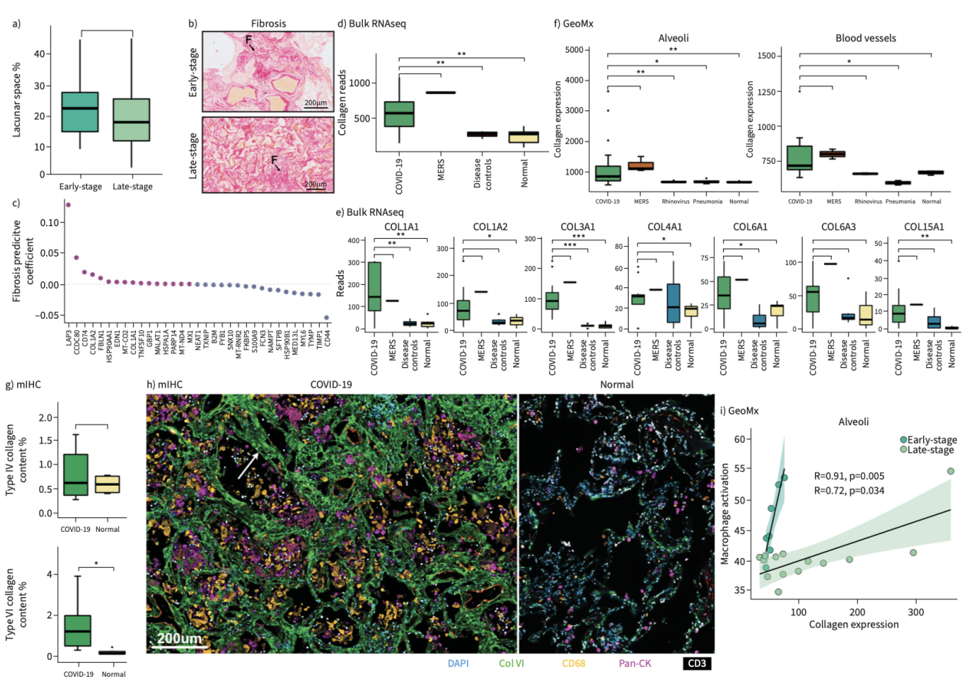
因为肺部巨噬细胞在胶原沉积中起到重要作用,研究发现了COVID-19肺内出现明显的纤维化,晚期病例肺泡壁增厚,胶原沉积显著。Bulk转录组和空间转录组发现了很多胶原相关基因在COVID-19肺中显著上调。相关性分析揭示了巨噬细胞活化基因和胶原基因存在显著正相关性。研究者通过多重免疫荧光检测了4种胶原类型(collagen type I, III, IV ,VI),结果发现了胶原VI在肺泡间质中特异性升高,而I/III/IV型胶原变化不显著。
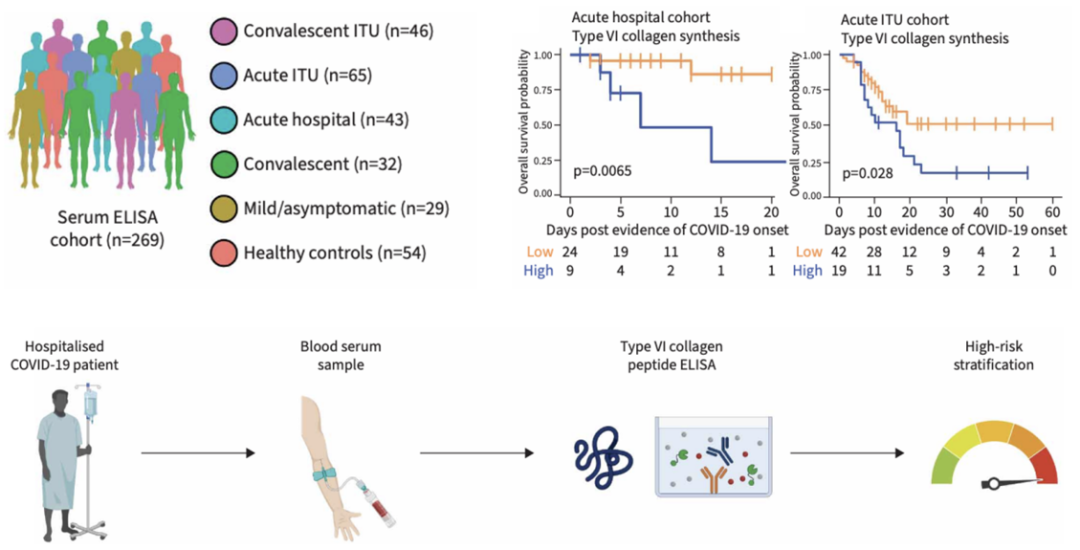
最后,研究者利用ELISA在215例COVID-19患者(轻症/无症状、急性住院、ICU、康复期)和54例健康对照的血清中检测了胶原合成/降解的相关标志物。结果发现了急性期患者中PRO-C6(胶原VI合成标志物)升高,且高水平与住院/ICU患者死亡率显著相关,可作为早期识别高危患者的潜在生物标志物。
总结与讨论
这项研究利用空间单细胞蛋白组明确了SARS-CoV-2感染局限于上皮/巨噬细胞,其微环境具有免疫抑制特性。首次提出胶原VI是COVID-19急性期肺泡损伤的关键介质,血清PRO-C6可作为风险分层工具。这项研究通过空间多组学联动分析,突破传统单技术局限,为未来感染性疾病研究提供了新范式。
华盈生物空间多模态研究体系
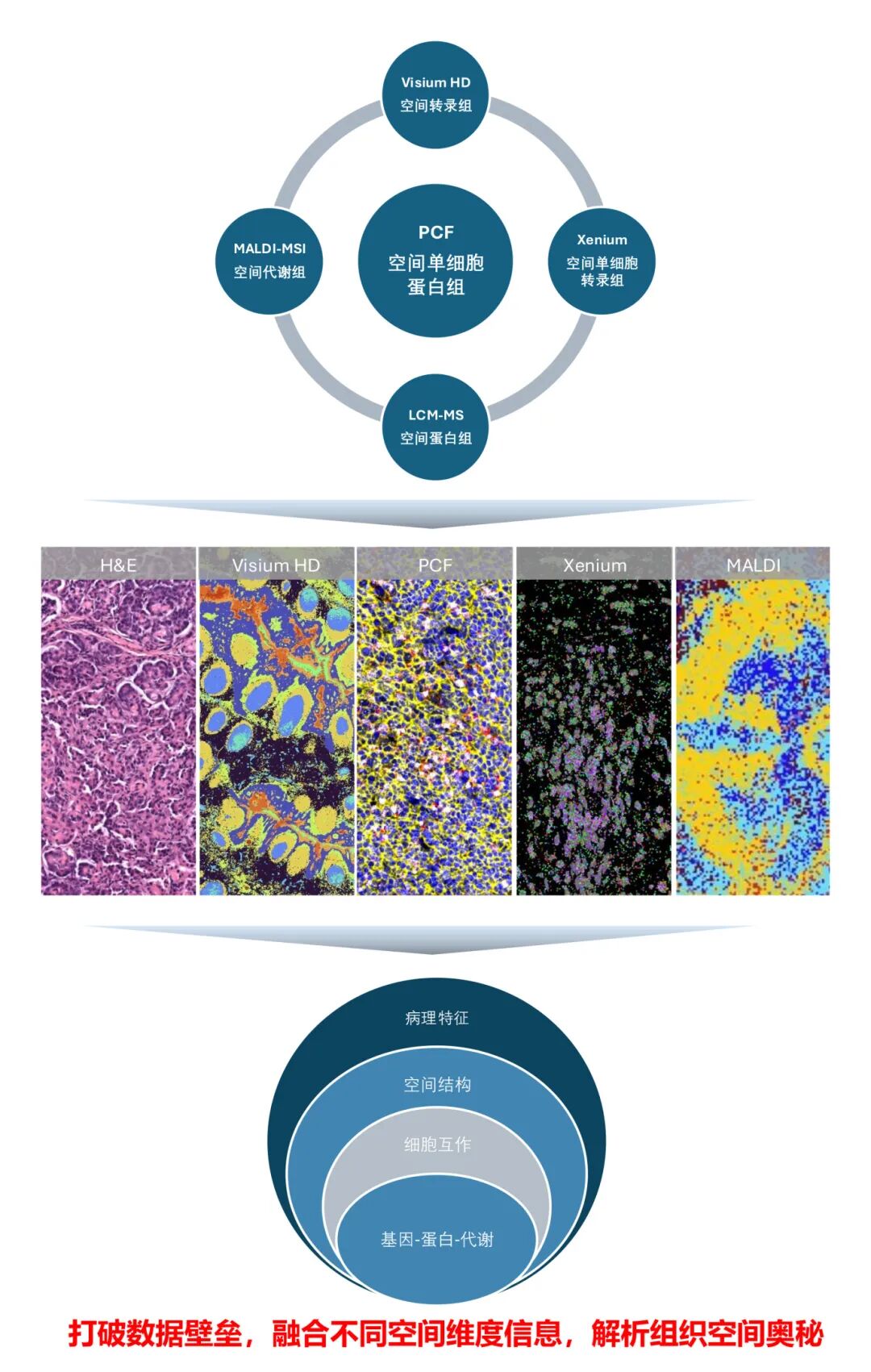
PCF空间单细胞蛋白组成像示例
相关文献
Fennell É, Taylor GS, Leahy CI, Ross AM, Reynolds G, Perry T et al.Multi-omic spatial profiling reveals the unique SARS-CoV-2 lung microenvironment and collagen VI as a predictive biomarker in severe COVID-19.Eur Respir J. 2025;66(3):2301699.