目录
[1. 单分子定位显微镜(SMLM):闪烁、定位与重建的艺术](#1. 单分子定位显微镜(SMLM):闪烁、定位与重建的艺术)
[2. 受激发射损耗显微镜(STED):用激光"雕刻"光斑](#2. 受激发射损耗显微镜(STED):用激光“雕刻”光斑)
[3. 结构光照明显微镜(SIM):通过频域解析突破极限](#3. 结构光照明显微镜(SIM):通过频域解析突破极限)
在生命科学和材料科学研究中,"看见"微观世界的精细结构是破解核心机制的关键。传统光学显微镜受限于光的衍射效应,存在约200nm的横向分辨率极限(阿贝极限),无法分辨突触囊泡(55nm)、膜蛋白簇(几十nm)等亚细胞超微结构。而单分子超分辨成像技术的出现,彻底打破了这一限制,将光学成像的分辨率推进到10-20nm级别,让我们得以在单分子水平观察生命活动的动态过程。
 使用SPINDLE(R)和Prime 95B成像的微管三维超分辨率重建图。左图:Cos7细胞免疫染色的微管蛋白,颜色编码深度。右图:左侧图像的放大区域,显示了深度超过2微米的微管。图片由Double Helix Optics提供。平均CRLB值横向约10nm,轴向约20nm
使用SPINDLE(R)和Prime 95B成像的微管三维超分辨率重建图。左图:Cos7细胞免疫染色的微管蛋白,颜色编码深度。右图:左侧图像的放大区域,显示了深度超过2微米的微管。图片由Double Helix Optics提供。平均CRLB值横向约10nm,轴向约20nm
无需扫描! SPINDLE可实现3D高精度单分子定位成像! - 仪器网
本文将从技术原理、核心方案、关键要点、实际应用和技术挑战五个维度,拆解这项"纳米级透视眼"技术的干货内容。
一、核心逻辑:如何突破衍射极限?
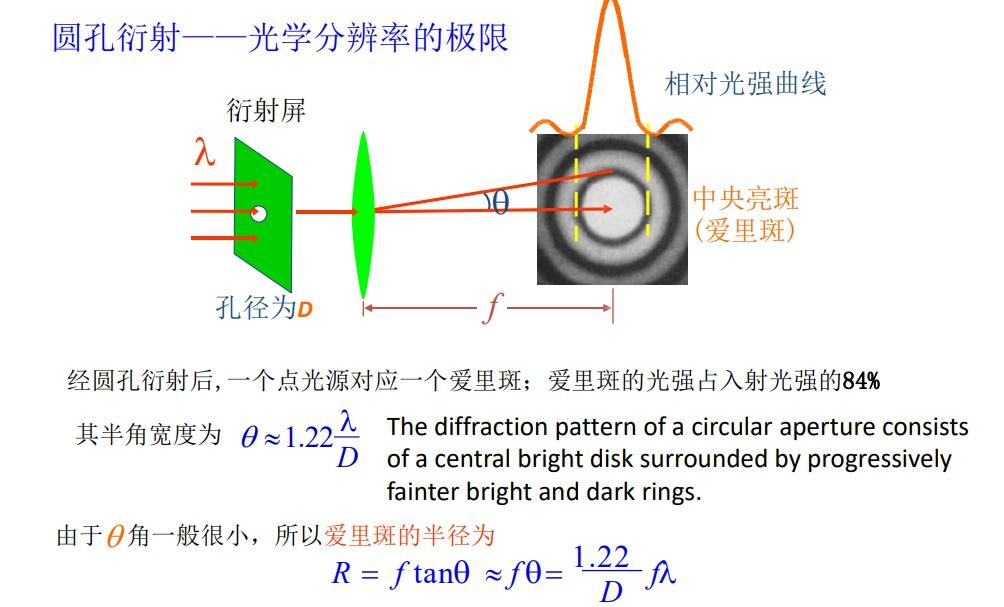
要理解单分子超分辨成像,首先要搞懂它突破衍射极限的核心思路。传统光学显微镜之所以存在分辨率瓶颈,是因为多个相邻分子发出的荧光会因衍射叠加成模糊光斑(艾里斑),无法区分。
 多光束的相互作用--衍射(Diffraction) - 知乎
多光束的相互作用--衍射(Diffraction) - 知乎
单分子超分辨成像的核心解决方案是"空间分离"或"光斑压缩",本质上是通过"时间换空间"或"光场调控",让原本重叠的分子信号变得可区分,再通过算法重建出高分辨率图像。
所有单分子超分辨成像技术都离不开三个关键组件:高灵敏度探测系统 (如EMCCD、sCMOS相机,量子效率需达90%以上,减少单分子信号的遗漏)、精准光操控模块 (如可切换激光、相位调制器,实现对荧光分子的选择性激活或抑制)、高效定位/重建算法(如高斯拟合、深度学习算法,实现单分子位置的精准计算)。这三者的协同优化,是技术落地的核心前提。
二、三大核心技术方案:原理、优势与适用场景
目前主流的单分子超分辨成像技术可分为三类:单分子定位显微镜(SMLM,含STORM/PALM)、受激发射损耗显微镜(STED)、结构光照明显微镜(SIM)。这三类技术各有侧重,适用场景差异显著,下表先明确核心参数对比:
| 技术类型 | 横向分辨率 | 成像速度 | 光毒性 | 核心优势 | 典型适用场景 |
|---|---|---|---|---|---|
| SMLM(STORM/PALM) | 20-30nm | 慢(0.1FPS,需数万帧叠加) | 中 | 分辨率最高,可定量分析分子数量 | 细胞骨架解析、膜蛋白分布、染色质纳米结构 |
| STED | 20-50nm | 快(毫秒级,可视频速率) | 高(需高功率激光) | 活细胞动态成像,实时追踪分子运动 | 突触囊泡融合、线粒体嵴动态变化 |
| SIM | 100-120nm | 较快(需9-15帧,可1kHz超快成像) | 低(低光强激发) | 兼顾速度与分辨率,适合活细胞长时程观测 | 内质网-线粒体互作、细胞分裂染色体排列 |
1. 单分子定位显微镜(SMLM):闪烁、定位与重建的艺术
SMLM是最具代表性的单分子超分辨技术,核心思路是**"时间换空间"** ,代表技术为STORM(Stochastic Optical Reconstruction Microscopy 随机光学重建显微术)和PALM(Photoactivated Localization Microscopy光激活定位显微术)。两者原理一致,仅荧光标记分子不同:STORM使用抗体偶联 的光可切换染料 ,PALM使用可光激活荧光蛋白。
至于它俩有什么区别,AI讲------
- 分子本质
- 光可切换染料:是人工合成的有机小分子,不属于蛋白质,需要和抗体进行偶联之后,才可以结合到样本的目标位置上
- 可光激活荧光蛋白:是一类经过基因工程改造的蛋白质,由细胞自身的基因表达或者通过转染的方式在细胞内表达
- 激活与工作的机制
- 光可切换染料:本身可以在不同波长的光的作用下,在荧光态和暗态之间进行切换;在成像的过程中,使用特定波长的光先让绝大多数的染料处于暗态,只随机激活一小部分处于荧光态的染料进行成像,之后再切换波长让这些荧光态的染料回到暗态,再激活另一部分,重复这个过程
- 可光激活荧光蛋白:本身在未被激活的时候,几乎没有荧光信号;需要特定波长的激活光来触发,使其从非荧光状态转变为荧光状态,而且一旦被激活之后,会在一段时间内保持荧光状态,之后会发生光漂白,不再产生荧光
- 标记的灵活性与靶向性
- 光可切换染料:因为是和抗体偶联,抗体可以识别样本中的特定抗原,所以可以标记样本内的绝大多数生物分子,包括蛋白质、核酸等,标记的靶向性由抗体的特异性决定,灵活性较高,既可以标记细胞内的分子,也可以标记细胞表面的分子
- 可光激活荧光蛋白:需要通过基因编辑的方式,把编码这种蛋白的基因和目标蛋白的基因进行融合,让细胞表达出融合了荧光蛋白的目标蛋白,所以只能标记可以进行基因编辑的样本的内源性蛋白,对于无法进行基因编辑的样本(比如临床的病理切片),无法使用
- 成像的稳定性与时长
- 光可切换染料:可以多次在荧光态和暗态之间切换,所以一次成像的过程中,可以重复激活的次数更多,能够收集到的单分子信号更多,最终的成像分辨率和图像质量的稳定性相对更好
- 可光激活荧光蛋白:被激活之后会逐渐发生光漂白,无法重复进行激活,所以一次成像过程中可以利用的信号次数有限
- 标记的操作难度
- 光可切换染料:标记过程是体外的免疫标记操作,步骤相对繁琐,需要进行样本的固定、透化、抗体孵育等多个步骤,而且需要控制抗体的浓度、孵育的时间和温度等条件,来保证标记的效率和特异性
- 可光激活荧光蛋白:标记过程是通过基因转染或者基因编辑的方式,让细胞自己表达融合蛋白,操作的步骤主要是在细胞培养的阶段完成,不需要进行复杂的体外孵育操作,但需要保证基因转染或者编辑的效率
SMLM成像的具体流程分为三步:
① 稀疏激活:通过低功率激光控制,让衍射极限内的荧光分子随机"闪烁"(同一时刻仅少数分子发光),确保相邻分子的信号不重叠;
② 精确定位:单个分子的荧光信号经物镜成像后形成艾里斑,通过高斯拟合算法计算艾里斑的质心,定位精度可达1-2nm;
③ 图像重建:采集数万帧包含单分子定位信息的图像,将所有分子的位置叠加,最终形成超分辨率图像。
为降低背景噪声,SMLM常与全内反射荧光(TIRF)技术 结合,通过倏逝波激发样品表层(≤1μm)的荧光分子,减少深层背景信号干扰。此外,DNA-PAINT 是SMLM的重要衍生技术,通过荧光标记的DNA寡核苷酸链与样品的动态结合/解离实现"闪烁",无需依赖染料的光切换特性,兼容性更强,但存在背景荧光较高的问题。
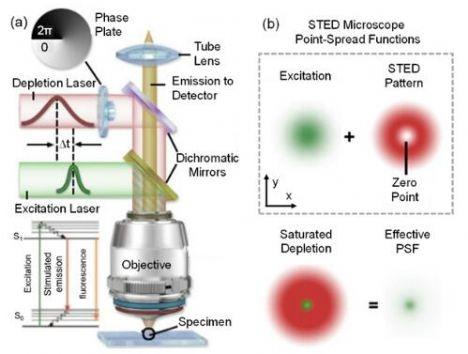
2. 受激发射损耗显微镜(STED):用激光"雕刻"光斑
STED(Stimulated Emission Depletion)的核心思路是"光斑压缩",通过两束激光的协同作用突破衍射极限:
① 激发激光:将样品中的荧光分子激发至高能态;
② 损耗激光:呈环形(甜甜圈状),仅作用于激发光斑的外围区域,**通过受激发射将外围区域的激发态分子"耗尽"至基态,使其无法发光。**最终只有环形中心极小区域(20-50nm)的分子能发出荧光,从而实现分辨率提升。
STED的优势是成像速度快,可实现视频速率(28-38.5FPS) 的活细胞动态成像,适合追踪突触蛋白运动、囊泡融合等快速生物过程 。但技术门槛较高:需要高功率连续波激光和精密的相位调制器件来生成环形损耗光,且高功率激光易导致光毒性,限制了活细胞长时程观测。最新研究通过低功耗探针(如碳纳米管标记物)和自适应光学技术,已显著缓解光毒性和样品折射率不均的问题。
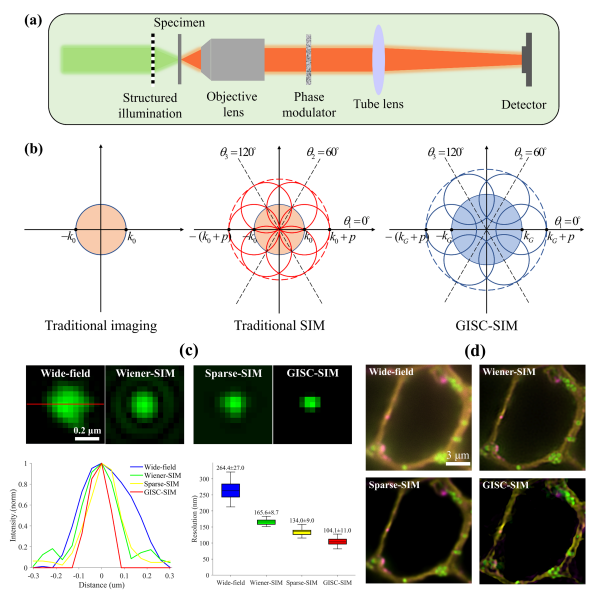
3. 结构光照明显微镜(SIM):通过频域解析突破极限
SIM的技术门槛最低、商业化最成熟,核心思路是"频域信息提取"。传统宽场显微镜无法捕捉样品的高频细节(对应纳米级结构),SIM通过向样品投射周期性的正弦结构光,使样品的高频信息被调制到可探测的低频区域(莫尔条纹效应)。通过采集不同角度、不同相位的9-15帧结构光图像,利用傅里叶变换算法分离、移位并重组高频信息,最终重建出分辨率提升1倍(~100nm)的超分辨率图像。
 多色超分辨结构光照明显微鬼成像研究取得进展----中国科学院
多色超分辨结构光照明显微鬼成像研究取得进展----中国科学院
SIM的最大优势是光毒性低,适合活细胞长时程成像 ,目前已开发出1kHz超快SIM系统,可用于观察培养神经元生长锥、树突棘等动态结构。但其分辨率提升有限 ,无法满足单分子级别的观测需求,更适合介于传统共聚焦和SMLM/STED之间的成像场景。
三、技术落地关键:从硬件到算法的核心要点
单分子超分辨成像不是"黑箱技术",其性能依赖于硬件选型和算法优化的细节,以下是几个实操层面的关键要点:
-
荧光探针选择:SMLM需选择光稳定性好、切换效率高的光可切换染料(如Cy5衍生物)或荧光蛋白(如PA-GFP),新型探针可将连续成像时间延长至30分钟;STED需确保探针的发射波长与损耗激光波长相匹配;SIM对探针兼容性最强,常规荧光染料即可使用。
-
探测器选型:核心需求是高量子效率、低读取噪声。EMCCD和sCMOS是主流选择,量子效率可达90%以上,读取噪声低于1e⁻/pixel;最新的超导纳米线单光子探测器(SNSPD)可将探测效率提升至98%,时间分辨率达50ps,适合单光子级别的信号检测。
-
算法优化:SMLM的定位速度和精度依赖算法,深度学习(如ResNet变体)可将定位速度提升至10⁶分子/分钟,开源软件SMLM-DL支持GPU加速;SIM的重建算法易受噪声干扰,压缩感知SIM(CS-SIM)可将信噪比提高3倍,但计算量会增加50%。
-
3D成像实现:平面分辨率提升后,轴向(Z轴)分辨率的优化同样重要。SMLM通过双物镜或散焦成像实现3D定位,轴向分辨率可达50nm;STED通过3D损耗光场实现75-100nm的轴向分辨率;3D-SIM则通过多层结构光叠加,轴向分辨率提升至300nm。
四、实际应用:从基础研究到临床转化
单分子超分辨成像的价值在于解决实际科学问题,以下是几个典型应用场景,均有明确的实验数据支撑:
-
细胞生物学:解析亚细胞结构动态:利用3D-SpecDIM(一种新型SMLM衍生技术),中国科学家首次实现单个线粒体自噬过程的全程实时监测,同步获取分子位置和微环境化学信息,为理解自噬机制提供了直接实验依据;STED显微镜可清晰观测突触前膜囊泡的分布密度(55nm)和突触后膜受体的簇状排列,解析突触可塑性的结构基础。
-
神经科学:突触超微结构分析:NMJ(神经肌肉接头)的关键特征(如活动区50-100nm、突触间隙50-100nm)均低于衍射极限,SMLM和STED可精准解析Ankyrin2-L蛋白的晶格结构(周期性~200nm),以及突触蛋白Piccolo、rapsyn的亚突触定位。
-
疾病机制与药物研发:在癌症研究中,超分辨成像可识别肿瘤细胞中膨胀的线粒体、破碎的溶酶体,以及药物处理后细胞骨架的重组;在阿尔茨海默病研究中,可追踪tau蛋白的异常聚集过程;在药物筛选中,可精准评估药物对靶点蛋白分布的影响,提升筛选精度。
-
材料科学:纳米材料表征:通过DNA-PAINT技术可实现纳米载体的精准定位,监测其在细胞内的运输过程;光声显微(PAM)与单分子成像结合,可实现无标记、高穿透深度(1mm)的纳米材料分布观测,检出直径0.3mm的肿瘤微转移灶。
五、当前挑战与未来方向
尽管单分子超分辨成像已广泛应用,但仍存在诸多技术瓶颈,这也是未来的研究重点:
-
深层组织成像能力不足:光学散射导致信号衰减,目前多数技术仅能观测样品表层(≤10μm),深层组织(如完整脑组织)成像需结合波前调制、超声编码聚焦等技术,将信号衰减控制在可接受范围。
-
活细胞成像的光毒性与速度平衡:SMLM成像速度慢,STED光毒性高,如何在保证分辨率的同时,实现快速、低光毒的活细胞长时程成像,是核心挑战之一。MINFLUX技术(结合荧光定位与激发光强度梯度)可实现1nm/1ms的定位精度,兼顾速度与精度,但系统复杂度极高。
-
多模态融合需求:单一成像技术无法同时获取结构、功能、化学信息,未来趋势是多模态集成,如CRS(相干拉曼散射)与PALM联用,可同时实现分子种类识别和纳米定位;ExM(膨胀显微)与SMLM结合,通过物理膨胀样品(4-10倍),可在普通显微镜上实现8nm分辨率。
-
数据处理与分析效率:数万帧、TB级的成像数据对存储和分析提出了极高要求,深度学习算法的优化(如自动化降噪、快速重建)是提升数据处理效率的关键。
六、总结
单分子超分辨成像的核心价值,是将光学显微镜的"视野"从微米级推进到纳米级,让我们得以在单分子水平"看见"生命活动和材料结构的本质。选择哪种技术方案,需根据研究需求(分辨率、成像速度、样品类型)综合判断:追求最高分辨率选SMLM,追求活细胞动态成像选STED,兼顾性价比和活细胞观测选SIM。
未来,随着硬件的小型化、算法的智能化和多模态技术的融合,单分子超分辨成像将逐步从专业实验室走向临床诊断、工业检测等领域,成为推动生命科学和材料科学突破的核心工具。对于科研人员而言,理解其技术原理和实操要点,才能更好地发挥这项技术的价值,产出高质量的研究成果。