01 前言
药物靶点的鉴定与验证是药物研发的核心环节,直接决定了药物研发的成功率。DARTS(Drug Affinity Responsive Target Stability)技术作为一种基于 "药物 - 靶点结合增强蛋白稳定性" 的靶点鉴定方法,凭借无需药物共价修饰、操作简便、适用范围广等优势,被广泛应用于已知靶点验证和未知靶点筛选。本指南将详细拆解 DARTS 技术的实验准备、操作步骤、结果分析及关键注意事项,为科研人员提供标准化的实操参考。
02 实验准备
一、 关键试剂
**▶ 裂解液:**M-PER (Thermo) 或 自制 TNS Buffer (50mM Tris-HCl pH 7.4, 150mM NaCl, 0.5% NP-40);
▶ **蛋白酶:**Pronase (Roche #10165921001 或 Sigma #P6911);
【注】Pronase是多种酶的混合物,切割位点广谱,是DARTS的首选。
▶ 小分子药物: 溶解于 DMSO 或 PBS;
▶ **蛋白浓度测定试剂盒:**BCA Assay Kit。
【重要提醒】裂解液中严禁添加任何蛋白酶抑制剂!可以添加磷酸酶抑制剂。
二、 仪器
▶ 冷冻高速离心机
▶ 金属浴/水浴锅 (控温 25℃ 或 Room Temp)
▶ SDS-PAGE 电泳及转膜系统
03 操作步骤
Step 1: 样品裂解
1. 收集细胞(约 107个)或研磨组织;
2. 加入冷裂解液(含磷酸酶抑制剂,无蛋白酶抑制剂),冰上裂解 10-15 min;
3. 14,000 rpm,4℃ 离心 10-15 min;
4. 收集上清液,立即进行 BCA 蛋白定量;
5. 将所有样品的蛋白浓度调整一致(建议 2-5 mg/mL)。
Step 2: 药物孵育
1. 将蛋白溶液分装;
2. 实验组:加入目标药物(常用浓度:10× 或 100× IC50,若未知建议 10-100 μM);
3. 对照组:加入等体积的溶剂(如 DMSO);
4. 孵育:室温孵育 30-60 min,伴随轻微晃动(避免剧烈涡旋破坏蛋白)。
Step 3: 限制性酶解 ------ 关键步骤
此步骤需预实验摸索最佳酶浓度,建议设置梯度。
1. 配制 **Pronase 母液:**用去离子水配制成 10 mg/mL,现配现用;
2. 酶解反应:
▶ 在药物组和对照组中分别加入 Pronase;
推荐比例酶(蛋白, w/w):建议设置 1:100, 1:500, 1:1000, 1:2000 四个梯度。
【注】初次实验必须摸索比例,寻找"对照组条带部分降解,药物组条带明显保留"的窗口。
3. **反应条件:**室温反应 15-30 min(时间需精确控制)。
Step 4: 终止反应
1. 直接向反应管中加入 5× SDS-PAGE Loading Buffer;
2. 立即置于 95-100℃ 金属浴煮沸 5-10 min。
【此时高温会使酶失活,无需额外加抑制剂;若无法立即煮沸,可先加大量蛋白酶抑制剂终止,再煮沸。】
Step 5: 检测与分析
1. 路径 A:已知靶点验证
▶ **实验:**Western Blot
▶ **结果判读:**对比同等酶浓度下,药物组的条带密度 > 对照组 (即 Drug+ 泳道有条带,DMSO 泳道条带消失或变淡),则证明药物结合保护了靶点。
场景 A:Western Blot 结果分析
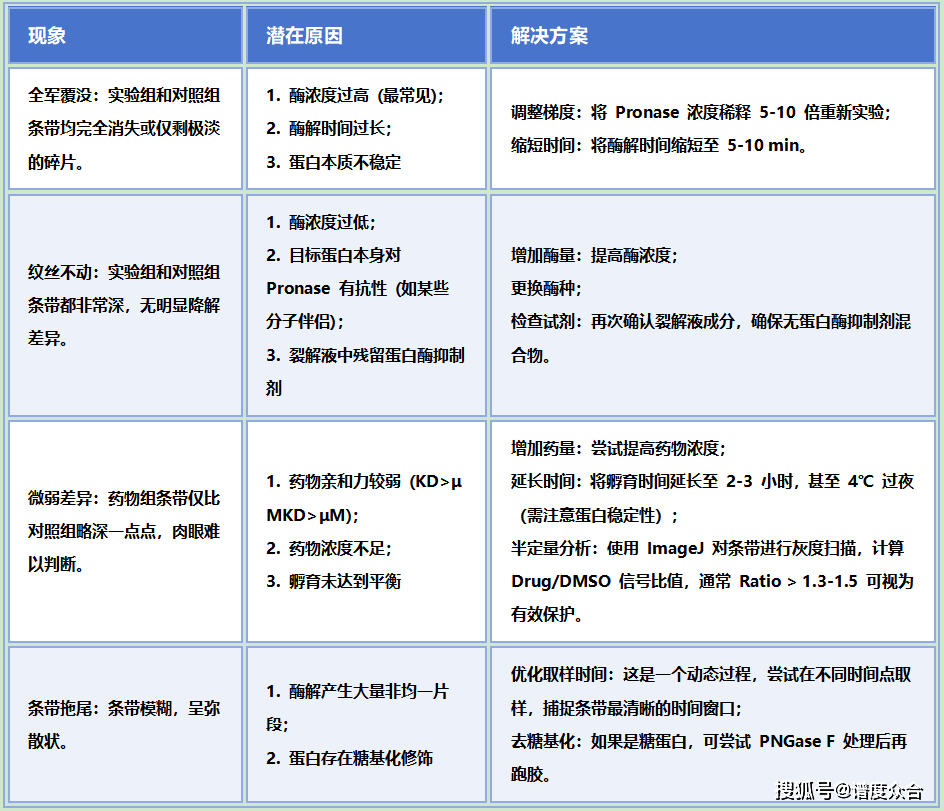
2. 路径 B:未知靶点筛选
▶ **实验:**进行 SDS-PAGE,跑胶至底部;考马斯亮蓝染色或银染;
▶ **差异分析:**寻找在药物组中存在(被保护)但在对照组中消失的条带;
▶ **鉴定:**切下差异条带,进行胶内酶解和 LC-MS/MS 质谱鉴定。
场景 B:质谱 (LC-MS/MS) 筛选结果分析
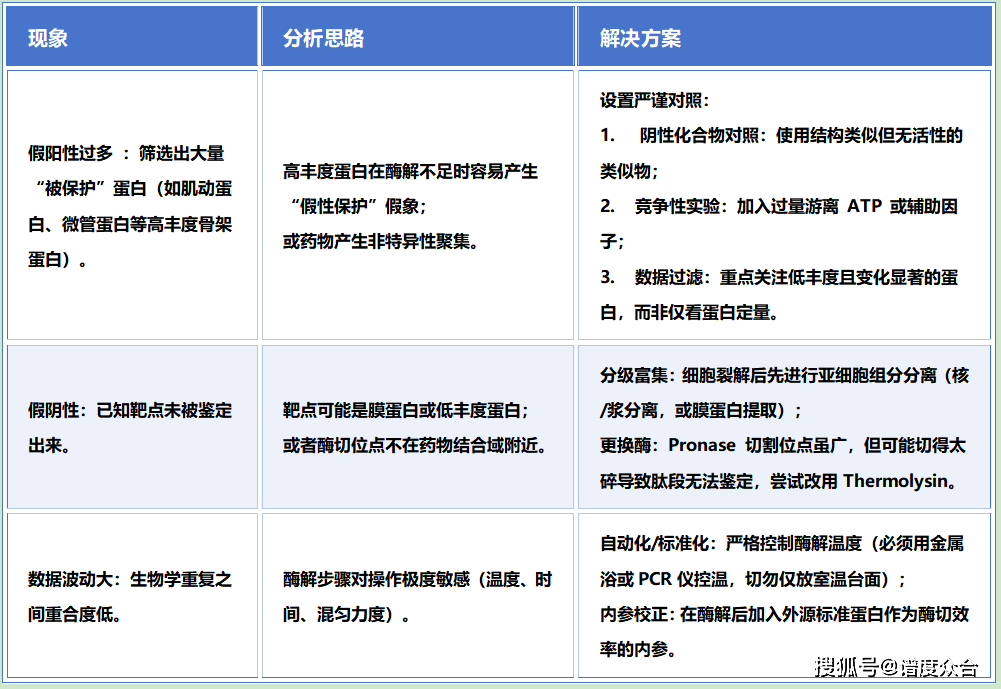
04 常见问题排查
1. 酶解过度或不足:
▶ 如果跑胶后,所有泳道都是碎片段或空白 ------ 酶太多/时间太长,降低酶比例。
▶ 如果对照组条带依然很亮,没有任何降解 ------ 酶太少/时间太短,增加酶比例或延长反应时间。
2. 膜蛋白处理:
膜蛋白在去垢剂胶束中可能对 Pronase 不敏感。若 DARTS 效果不佳,建议尝试 TPP (Thermal Proteome Profiling) 或 LiP-MS 技术。
3. 非特异性保护:
高浓度药物可能会引起非特异性的蛋白聚集,导致假阳性。建议增加阴性对照化合物(结构类似但无活性的分子)进行验证。
4. DNA干扰:
如果是 DNA 结合蛋白,DNA 的存在会保护蛋白。裂解时建议加入 DNAse 去除核酸干扰。
5. 数据呈现:
**文章发表时,务必展示酶浓度梯度的胶图,**证明是在"限制性酶解"条件下观察到的保护作用,而非酶没起作用。
05 进阶分析
1. "GAPDH 陷阱":
做 WB 时,千万不要习惯性地只把 GAPDH/Actin 当作 Loading Control。
▶ **原因:**在 DARTS 实验中,Loading Control 是为了证明起始蛋白量一致,而不是证明酶解后一致。
▶ **操作:**应该在未加酶的样品中跑 GAPDH 来证明上样量一致;在加酶的样品中,GAPDH 理论上应该也被降解(除非它是靶点)。如果加酶组 GAPDH 完好无损,说明酶没起作用。
2. 别构效应的判断:
如果你发现全长蛋白条带减少了,但下面出现了一个清晰的小分子量截断条带,且这个截断条带在药物组中被增强/保护了。
这通常意味着药物结合引起了蛋白构象变化,或者药物结合在特定的结构域,这是一个非常有价值的结构生物学线索。
3. 统计学意义:
发表文章时,Reviewer 通常要求至少 3 次独立重复实验的 Western Blot 图片,并配上灰度定量的柱状图,标注 P 值。单次胶图很难被接受。
06 DARTS技术的升级方案 ------ LiP-MS技术
尽管 DARTS 技术在靶点验证中表现优异,但在未知靶点筛选场景中仍存在局限性:
▶ 依赖 Western Blot 或质谱对差异条带的鉴定;
▶ 对低丰度蛋白、膜蛋白的覆盖不足;
▶ 筛选过程中易出现假阳性 / 假阴性。
而 LiP-MS技术作为 DARTS 的升级版,完美解决了这些痛点,其核心优势在于不依赖抗体,实现了更高效、更全面的药物靶点筛选。
原理一致但技术升级
LiP-MS 沿用了 "药物结合靶点→蛋白构象改变→酶解抗性差异" 的核心原理,但在技术流程上进行了关键优化:首先,采用更精准的限制性酶解策略,结合定量蛋白质组学技术,无需通过凝胶分离差异条带,直接对酶解后的肽段进行质谱分析;其次,通过比较药物组与对照组中各蛋白的肽段丰度差异,可快速锁定被药物保护的靶蛋白,无需依赖特异性抗体进行验证。
Buff加成
相较于 DARTS,LiP-MS 的优势体现在三方面:
▶ 覆盖范围更广,能有效检测膜蛋白、低丰度蛋白等 DARTS 难以捕捉的靶点;
▶ 筛选效率更高,避免了凝胶染色、条带切割等繁琐步骤,实现高通量筛选;
▶ 特异性更强,通过肽段水平的定量分析,减少了高丰度蛋白带来的假阳性干扰。
因此,当研究中缺乏靶点抗体、需快速筛选未知靶点,或针对膜蛋白等特殊靶点时,LiP-MS 是比 DARTS 更优的选择。
结语
DARTS 技术作为经典的靶点鉴定工具,其核心在于通过 "限制性酶解条件的精准优化" 和 "严谨的对照设计",实现已知靶点的高效验证和未知靶点的初步筛选,操作简便、成本可控,是药物研发初期的重要手段。而 LiP-MS 技术作为其升级版,以 "不依赖抗体" 的核心优势,突破了 DARTS 在筛选范围和效率上的局限,为未知靶点筛选提供了更强大的技术支撑。
科研人员在实际应用中,可根据实验目的灵活选择:已知靶点验证优先采用 **DARTS 技术,兼顾性价比与可靠性;未知靶点筛选、无抗体可用或针对特殊蛋白(如膜蛋白、低丰度蛋白)时,建议采用 LiP-MS 技术。**无论选择哪种技术,都需重视预实验摸索、标准化操作和生物学重复,同时结合竞争性实验、阴性对照等手段排除干扰,确保实验结果的真实性和可靠性。希望这篇指南能为大家提供清晰的实操参考,助力药物靶点鉴定工作的顺利开展~
LiP-MS药物靶点筛选技术!⬅️⬅️⬅️药物靶点研究3大场景轻松破局
**✓ 药物靶点筛选:**在体外生理条件下,寻找小分子药物可能的作用靶点。
**✓ 药物-蛋白结合域分析:**于体外生理条件中,探究纯化重组蛋白和目标药物的作用区域以及结合位点。
**✓ 药物机制研究:**在体内给药的条件下,钻研小分子药物潜在的作用靶点及其发挥作用的机制。
参考资料
1\] Lomenick B, Hao R, Jonai N, et al. Target identification using drug affinity responsive target stability (DARTS). Proc Natl Acad Sci U S A. 2009;106(51):21984-21989. \[2\] Pai MY, Lomenick B, Hwang H, et al. Drug Affinity Responsive Target Stability (DARTS) for Small-Molecule Target Identification. Methods Mol Biol. 2015;1263:287-298. \[3\] Schenone M, Dančík V, Wagner BK, Clemons PA. Target identification and mechanism of action in chemical biology and drug discovery. Nat Chem Biol. 2013;9(4):232-240.