引言
接触细胞热位移分析(Cellular Thermal Shift Assay,CETSA)实验以来,从最初的手忙脚乱到逐渐熟练上手,其间踩过不少坑,也从 Research Gate、Biostars 论坛的前辈分享中汲取了很多经验。++这款能直接在细胞内验证药物++ ++- 靶点相互作用的技术,原理巧妙但操作细节要求极高,任何一个环节的疏忽都可能让辛苦收集的数据作废。++
今天就给大家分享一下,我在实验中遇到的常见问题、解决心得以及技术拓展的感悟,希望能给大家一些参考**++(结尾附问题快速查阅表)++。**
01 那些年踩过的坑:常见问题排查心得
1. Western Blot 的"鬼影"难题:高背景的4个解决关键
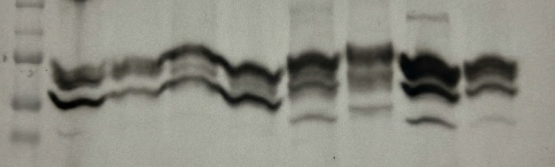
刚开始做CETSA-WB时,最让我崩溃的就是显影后膜上出现的"窗帘状"背景和黑斑,信噪比低到根本无法定量。后来反复尝试和排查,才发现问题大多出在细节上:
▶ 膜的干燥是隐形杀手:
有一次我在换液时,不小心让膜的边缘暴露在空气中几秒钟,结果那片区域就出现了明显的黑斑。
后来才知道,**++膜一旦短暂干涸,疏水性就会改变,抗体容易非特异性吸附。++**现在我操作时会格外注意,全程让膜浸泡在液体中,尤其是PVDF膜,转膜前一定会用甲醇充分活化,避免任何干涸的可能。
▶ 封闭液选对才有效:
一开始我沿用了磷酸化抗体实验常用的BSA封闭,结果背景一直很高。
后来看到论坛专家分享,**++CETSA检测总蛋白时,5%脱脂奶粉的封闭效果更好。++**我试着将封闭时间延长到1.5小时,并且确保奶粉完全溶解无颗粒,背景果然大幅降低。
▶ 抗体浓度千万别贪高:
作为新手,我曾误以为抗体浓度越高信号越强,结果导致全膜非特异性结合。
++经过多次滴定才找到合适的浓度,尤其是高灵敏度的ECL底物,二抗稀释到1:30000左右效果最佳,最高甚至用到过1:50000,既保证了信号强度,又能有效降低背景。++
▶ ECL底物处理要细致:
有几次显影时,条带发光极强但瞬间就灭了,背景还出现液流痕迹。
后来才明白是**++ECL底物积聚导致的++**,现在加完底物后,我会用吸水纸轻轻吸去膜角多余的液体,只留一层薄薄的液膜,再覆盖保鲜膜成像,这样就能避免上述问题。
2. 熔解曲线异常:平坦、鼓包该怎么破?
熔解曲线是CETSA的核心数据,我曾多次遇到曲线不符合预期的情况,总结下来主要有这几种情况:
▶ 曲线平坦无下降:
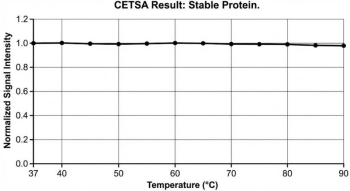
第一次做实验时,无论温度怎么升高,蛋白信号都没明显下降,当时以为是抗体失效了。
后来排查才发现,**++目标蛋白的热稳定性极强,Tm值超过80℃,常规的67℃最高温根本不足以让它聚集。++**我将最高温提升到90℃后,曲线就呈现出了正常的S型。
还有一次是**++因为抗体识别线性表位,离心不彻底导致沉淀复溶++**,后来我把离心力提高到20000×g,离心20分钟,吸取上清时格外小心不触及沉淀,问题就解决了。
▶ 曲线下降过于平缓:
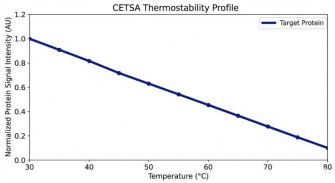
++这种情况大多是裂解液的问题。++ 我曾用过含高浓度SDS的裂解液,结果热聚集的蛋白又被重新溶解,曲线自然平缓。后来换成0.6%的NP-40温和裂解液,就再也没出现过这种情况,++大家尽量避免使用强去污剂。++
▶ 40-50℃区间的"鼓包":
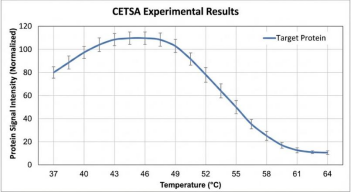
有段时间实验中总是出现信号先上升后下降的情况,37℃时信号反而较低。
查了论坛才知道,这是因为37℃时抗原表位被遮蔽,适度加热后表位暴露,抗体结合力增强。++后来我调整了数据处理方式,以"鼓包"的最高点作为100%归一化,数据就变得合理了。++
3. 负向热位移:曾让我慌了神的"意外发现"
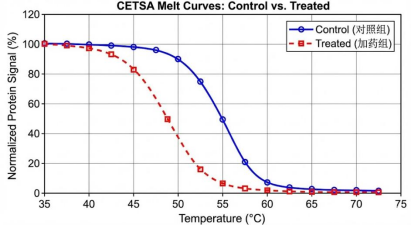
第一次遇到加药组Tm值比对照组低(ΔTm<0)时,我以为实验失败了,差点把数据丢掉。后来在论坛上看到很多人都讨论过这个问题,才明白自己犯了一个常识性错误。
++负向热位移不仅不是失败,反而可能是特定结合模式的有力证据。++
比如有些配体对蛋白去折叠态的亲和力高于天然态,会拉动平衡向去折叠方向移动,从而降低Tm值;还有些药物会破坏蛋白的多聚体结构,让它更容易热变性。我后来重复了实验,确认这种负向位移具有剂量依赖性,查阅相关文献后发现,这与我研究的药物作用机制完全契合。所以现在再遇到这种情况,我会格外留意,而不是盲目判定实验失败。
02 从基础到进阶:我的CETSA技术拓展之路
随着课题的深入,传统的CETSA-WB已经满足不了需求,比如需要筛选大量化合物或者寻找未知靶点时,我就开始尝试质谱联用的技术,过程中也有不少新感悟。
CETSA-MS/TPP:无偏倚靶点发现的利器
在寻找药物未知靶点时,CETSA-MS(TPP)技术给了我很大的惊喜。
它的流程也不复杂,样品加热离心后取上清,酶解成肽段,用TMT同位素标签标记后进行LC-MS/MS分析,我之前也整理过实验指南:《TPP热蛋白组分析:从操作到分析零门槛的实操指南-CSDN博客》,感兴趣的小伙伴可以自行阅读。
++一次实验就能测定细胞内数千个蛋白的熔解曲线,不仅能找到直接靶点,还能发现下游相关蛋白的变化,从而揭示药物的作用机制。数据分析比较复杂,需要和生物信息学团队合作,但得到的结果非常有价值,能让我们更全面地了解药物的作用网络。++
03 自用实用表格分享:实验效率提升小帮手
在长期实验中,我整理了两个实用表格,平时遇到问题或选择技术方法时,翻一翻就能快速找到答案,分享给大家:
表 1:CETSA 常见检测方法对比(自用整理版)
| 特性 | CETSA-WB(经典法) | CETSA-MS(TPP)(TPP) |
| 通量 | 低(1-10 个化合物) | 中(全蛋白组) |
| 检测对象 | 内源性蛋白 | 内源性全蛋白组 |
| 主要用途 | 靶点验证 | 靶点发现、作用机制研究 |
| 我的使用感受 | 操作简单无需特殊设备适合初期验证 | 无偏倚,能发现脱靶效应 |
| 注意事项 | 依赖抗体质量操作要细致 | 样品制备和数据处理需严格质控 |
|---|
表 2:常见问题快速查阅表(结合自身经验补充)
| 现象 | 可能原因 | 我的应对方法 |
| 全板无信号 | 细胞流失、裂解不充分 | 检查离心后沉淀量,改用反复冻融 + 强裂解液,确保细胞充分裂解 |
| 熔解曲线平坦 | 最高温不够、抗体识别线性表位 | 提高最高温至 90℃,更换识别构象表位的单克隆抗体 |
| 负向热位移 | 结合去折叠态、构象破坏 | 重复实验确认剂量依赖性,查阅文献验证机理,保留有效数据 |
| WB 背景脏 | 膜干燥、封闭不足、抗体过浓 | 全程保持膜湿润,用 5% 奶粉延长封闭时间,大幅稀释二抗 |
| 复孔差异大 | 加热不均、边缘效应 | 使用高质量 PCR 板,提前检查 PCR 仪孔位温度均一性,操作时保持条件一致 |
|---|
结语
做 CETSA 实验的这些年,从最初用 CETSA-WB 摸索基础操作,到后来借助 CETSA-MS(TPP)突破研究瓶颈,我真切感受到不同技术范式带来的科研视野升级。
最初选择 CETSA-WB,正是看中它操作简单、无需特殊设备的优势,帮我解决了课题初期 "靶点是否有效"的核心疑问。但随着研究深入,它的局限也逐渐显现:++通量低,一次只能验证++ ++1-10 个化合物;依赖抗体质量,遇到难制备抗体的蛋白就束手无策;更无法触及未知靶点,难以揭示药物背后复杂的作用网络。++
而 CETSA-MS(TPP)的出现,恰好弥补了这些短板。++它无需依赖抗体,一次实验就能测定细胞内数千个蛋白的熔解曲线,不仅能无偏倚地发现药物的直接靶点,还能捕捉到下游相关蛋白的稳定性变化,甚至揭示脱靶效应++,让我对药物作用机制的理解从 "单点验证" 升级到 "全景解析"。
当然,两者并非替代关系:CETSA-WB 适合快速验证、初期筛选,是科研路上的 "高效探针";CETSA-MS(TPP) 适合深度挖掘、机制探索,是破解复杂问题的 "精密地图"。
这段经历也让我明白,科研技术没有绝对的优劣,只有是否适配当下的研究需求,希望我的这些实战笔记能给大家一些启发~

谱度众合 ------ 首个蛋白质组水平无偏倚靶点筛选方法⬅️⬅️⬅️点击链接了解更多
▶ **全面直接筛选真实药靶组合:**蛋白质组水平筛选药物结合的蛋白靶点,全面覆盖治疗靶点与脱靶靶点;使用药物分子本体进行试验,无需设计合成分子探针,药靶结合更真实
▶ **多种数据分析策略:**结合蛋白热变性曲线分析和非参数分析方法(NPARC),全面捕获潜在药物靶点
▶ **多种生信分析数据库挖掘辅助筛选:**对潜在药物靶点进行生信分析与数据库挖掘,辅助最终药物靶点的确认
▶ **多种衍生技术可选:**除常规温度范围(TPP-TR)、药物浓度范围(TPP-CCR)、两者结合(2D-TPP)的常规热蛋白组分析方法外,还可进行单温度点(ITSA)、多温度点混合(PISA)等高通量热蛋白组分析方法
参考资料
-
Tu Y, Tan L, Tao H, Li Y, Liu H. CETSA and thermal proteome profiling strategies for target identification and drug discovery of natural products. Phytomedicine. 2023;116:154862. doi:10.1016/j.phymed.2023.154862
-
Kalxdorf M, Günthner I, Becher I, et al. Cell surface thermal proteome profiling tracks perturbations and drug targets on the plasma membrane. Nat Methods. 2021;18(1):84-91. doi:10.1038/s41592-020-01022-1
-
Zhang L, Wang Y, Zheng C, et al. Cellular thermal shift assay: an approach to identify and assess protein target engagement. Expert Rev Proteomics. 2024;21(9-10):387-400. doi:10.1080/14789450.2024.2406785