重组蛋白表达系统是现代生命科学研究和生物技术服务行业的基础性技术平台。从科研试剂的角度,重组蛋白表达系统不仅支撑着基础研究、药物靶标验证、抗体筛选等多种实验,还为生物公司提供了稳定、可控的蛋白样品来源。
一、重组蛋白表达系统概述
重组蛋白表达系统是指将目标基因通过分子克隆技术整合到适合的载体中,并在选定的宿主细胞内表达,以获得目标蛋白质的技术平台。重组蛋白表达系统的核心技术要素包括表达载体、宿主系统、表达调控元件以及表达产物的稳定性和可溶性。
在科研中,选择合适的重组蛋白表达系统决定了实验的成功率、产物的质量以及后续实验的可行性。重组蛋白表达系统可以粗略分为两大类:
原核表达系统:以大肠杆菌为主要代表。
真核表达系统:包括酵母表达、昆虫细胞表达及哺乳动物细胞表达系统,例如 HEK293 和 CHO。
二、原核重组蛋白表达系统
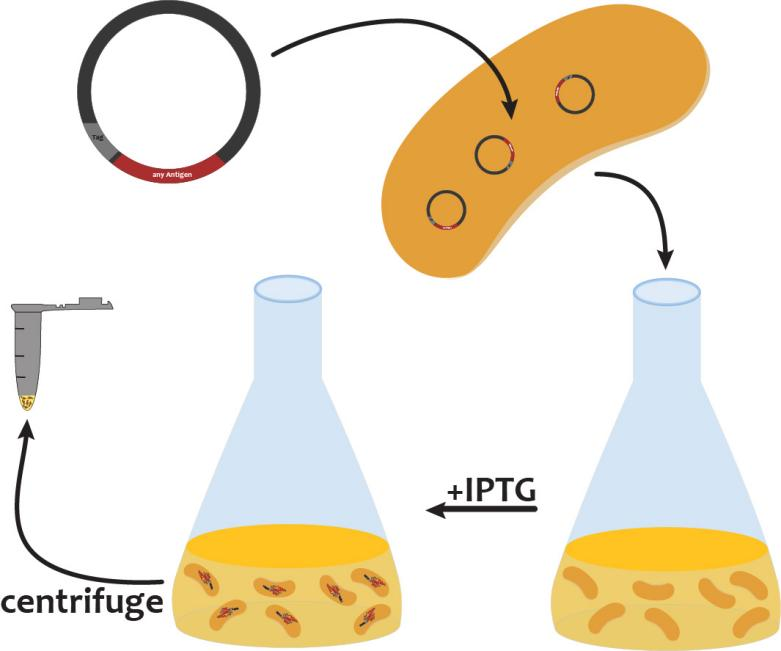
1. 大肠杆菌表达系统
大肠杆菌表达系统是目前应用最广泛的重组蛋白表达系统之一。其主要优势包括表达速度快、成本低、易于操作及高表达水平。这使得大肠杆菌成为科研试剂领域首选表达宿主。
在大肠杆菌表达中常用的技术包括:
融合标签(Fusion Tag):例如 His 标签、GST(谷胱甘肽 S-转移酶)标签等,用于增强可溶性与纯化便利性。
表达载体设计:采用可调控启动子(如 T7 启动子)以实现高效表达。
可溶性表达策略:通过调整培养温度、表达诱导条件、共表达分子伴侣等方法,提高目标重组蛋白可溶性。
大肠杆菌系统非常适合表达非糖基化的、分子量较小的蛋白。然而,该系统在表达复杂折叠结构或需要后转译修饰的蛋白时常常面临可溶性低、包涵体形成等技术难题。
三、真核重组蛋白表达系统
真核重组蛋白表达系统能提供比原核系统更接近天然状态的蛋白产物,尤其适用于需要正确折叠、复杂构象或者后转译修饰的蛋白质。
1. 酵母表达系统
酵母表达系统 常用代表为 Pichia pastoris 和 Saccharomyces cerevisiae。酵母系统兼具原核表达系统的易操作性和真核系统的部分修饰能力:
能进行有限的糖基化和折叠辅助。
表达速度较快,且培养条件简单。
可在发酵罐中实现高密度培养,提高重组蛋白产量。
酵母系统适合中等复杂度蛋白表达,但其糖基化模式与哺乳动物细胞有所差异,可能影响某些蛋白的功能特性。
2. 昆虫细胞表达系统
昆虫细胞表达系统常采用杆状病毒系统(Baculovirus Expression Vector System,简称 BEVS)。该系统能够:
支持复杂蛋白质的折叠与多种后转译修饰。
表达大分子量蛋白或多亚基复合体。
昆虫细胞系统在科研试剂领域常用于结构生物学、功能分析需要接近天然构象的蛋白表达。
3. 哺乳动物细胞表达系统
哺乳动物细胞表达系统以 HEK293 和 CHO 细胞为主。其主要优势在于:
能进行与人体高度一致的后转译修饰,如糖基化、磷酸化等。
蛋白结构与生物活性更接近天然蛋白。
特别适用于表达复杂结构、多亚基蛋白以及需要高活性、功能完整性的重组蛋白。
HEK293 系统因转染效率高、表达周期短在科研领域广泛应用;CHO 系统则以稳定表达和大规模生产能力见长。
四、各表达系统技术比较
|--------------|--------------|---------------|--------------|
| 表达系统 | 优势 | 限制 | 典型应用 |
| 大肠杆菌 | 低成本、快速表达、高产量 | 无真核修饰,易形成包涵体 | 小分子蛋白、无修饰蛋白 |
| 酵母表达 | 真核修饰、易培养 | 糖基化模式与哺乳动物不同 | 中等复杂度蛋白 |
| 昆虫细胞 | 良好折叠、复杂蛋白 | 成本较高于酵母 & 原核 | 多亚基/大分子蛋白 |
| 哺乳细胞 | 人源化修饰、最高保真度 | 成本高、周期长 | 复杂功能蛋白、抗体片段 |
五、相关技术术语解释
为了帮助科研专业读者更好理解重组蛋白表达系统中的常见术语,以下术语在行业内具有较高的使用频率:
• 表达载体设计
表达载体是将目标基因整合并导入宿主系统的 DNA 元件,优良设计影响表达效率。
• 融合标签(Fusion Tag)
常见融合标签如 His、GST、MBP 等用于提升表达可溶性,并简化亲和纯化流程。
• 可溶性表达
蛋白以可溶形式存在于细胞裂解液中,更易进行纯化与后续实验应用。
• 后转译修饰(PTM)
真核系统特有的修饰方式,如糖基化、磷酸化等,在药物靶标验证、结构分析中常见。
六、重组蛋白表达系统的科研价值
在生命科学研究中,各类表达系统根据目标蛋白的结构、功能及研究需求提供不同的解决方案。科研试剂领域重组蛋白技术的成熟,使研究者能够:
获得高纯度、高活性的蛋白质样品;
实现高通量筛选、结构解析和功能验证;
调整表达条件以满足不同实验需求。
参考文献(Nature 引用格式)
1.Smith, D. B. & Johnson, K. S. Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase. Gene 67, 31--40 (2020).
2.Daly, R. & Hearn, M. T. Expression of heterologous proteins in Pichia pastoris : a useful experimental tool in protein engineering and production. J. Mol. Recognit. 33, e2851 (2021).
3.van Oers, M. M. & Pijlman, G. P. Thirty sweet years of baculovirus--insect cell protein expression: from dark horse to mainstream technology. J. Gen. Virol. 102, 1215--1225 (2021).
4.Rosano, G. L. & Ceccarelli, E. A. Recombinant protein expression in Escherichia coli : advances and challenges. Front. Microbiol. 10, 421 (2019).