生物制药企业的 IT 管理者,是否经常被这些问题反复困扰?
FDA 核查临近,发现 AD 账号操作日志缺失,短时间内难以补齐;
CRO 机构研究人员急需访问 CTMS 或 LIMS 系统,权限审批流程却无法提速;
生产车间设备账号密码到期未处理,MES 系统短暂停机,直接触及 GMP 合规红线。
这些问题表面上是账号管理失误,实质上反映的是 Active Directory(AD)管理能力不足。作为企业全域系统的统一身份核心,AD 连接着研发、临床、生产与质量等关键业务系统,其管理水平直接决定了合规稳定性、业务连续性与安全可控性。
在监管持续趋严、研发节奏不断加快的背景下,依赖人工操作和分散工具的 AD 管理模式,已难以支撑生物制药企业的长期发展。基于对数十家头部生物制药企业的实践经验,ManageEngine ADManager Plus 针对行业真实场景,构建了覆盖合规管控、效率提升与安全防护的三维 AD域管理解决方案,为药企建立可持续的身份治理体系提供了可落地路径。
一、权限"最小化":让敏感数据只对该看的人开放
生物制药企业的核心数据------从临床试验患者信息、基因测序数据,到药品配方生产参数------都藏在各类系统里,而AD账号就是这些系统的"钥匙"。权限给多了有泄露风险,给少了影响工作,ADManager Plus的"全流程角色权限体系"刚好解决这个问题,实现"行级+列级"的精准授权:
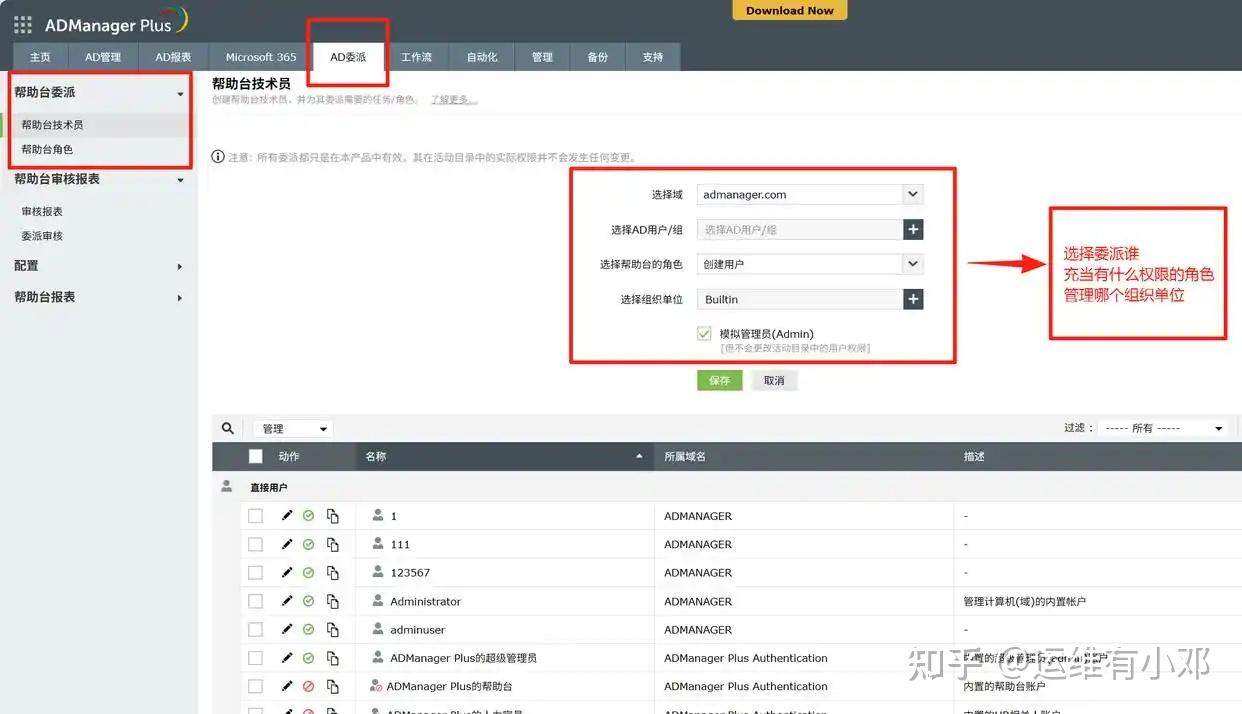
研发团队仅能访问CTMS/LIMS系统关联的AD账号权限,无法触及生产车间的MES系统操作权限;
针对人类遗传资源相关数据的操作账号,可设置"多人审批+操作留痕"机制,完全契合《人类遗传资源管理条例》要求;
自动识别Domain Admins等特权实体群组,实时监控特权账号的权限变更,避免"超级账号"滥用导致的数据泄露风险。
二、合规报告自动化:150+模板,NMPA飞检直接用
《药品管理法》要求"全过程信息真实可追溯",但这并不依赖AD审计,而是需要清晰的账号管理记录。ADManager Plus内置150+种合规报告模板,刚好契合医药行业的监管需求:
(1)账号权限分配报告"可按部门、系统分类,清晰呈现谁拥有CTMS/LIMS/MES的访问权限;
(2)"特权账号清单"自动梳理Domain Admins等高危账号,标注权限范围和最近操作人;
这些报告不是简单的信息罗列,而是完全按合规要求设计。比如针对GCP临床试验,可生成"项目关联账号报告",清晰展示某一试验项目下所有相关账号的开通时间、权限范围和审批人,实现"账号-项目-权限"的精准对应。
(3)内置PCI DSS、ISO 27001、HIPAA等合规模板,NMPA或FDA核查时,选好时间范围点"导出",PDF格式报告直接生成;
支持报告定时发送,可设置每周自动将"权限变更报告"发送给合规部门,不用IT手动整理;
"非活跃账号清单"自动识别30天未登录的账号,避免离职员工残留权限带来的合规风险。
有个做原料药的客户说,之前准备合规材料要15天,现在1小时就能搞定,IT团队终于不用在核查前通宵了。
三、账号全流程自动化:从入职到离职,权限自动跟着人走
新药研发常涉及CRO机构、临床医院等跨主体协作,账号开通与注销频率极高。ADManager Plus的"账号生命周期自动化"功能,让权限管理完全跟上业务节奏:
(1)基于HR系统数据自动触发账号创建,为研发人员批量配置CTMS、LIMS系统的访问权限,新员工入职权限开通时间从2天缩短至10分钟;
(2)临床试验结束后,自动冻结CRO机构人员的AD账号,避免协作终止后的数据泄露风险;
(3)针对生产车间的轮岗员工,自动同步更新MES系统与设备管理系统的权限,确保生产环节权限精准匹配岗位职责。
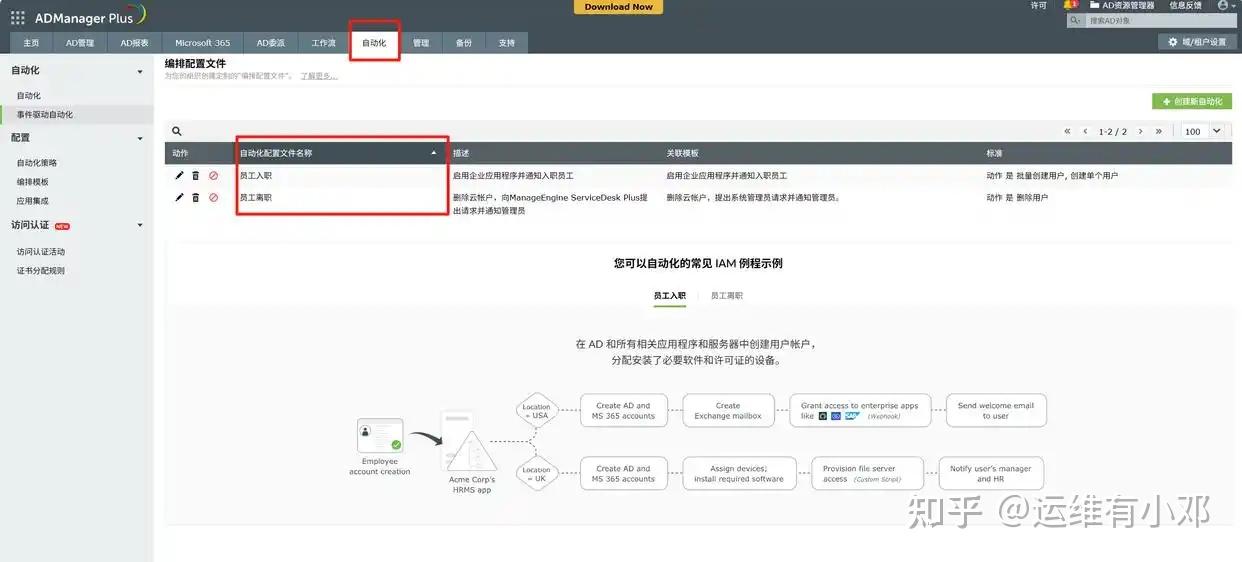
这种自动化不只是省人力,更能避免合规漏洞。比如有个客户和CRO机构合作结束后,系统按合同时间自动冻结对方账号,同时生成"账号冻结报告",这份报告就是合规核查时的重要凭证。
四、结语:AD域管理是生物制药企业的基础能力
对于生物制药企业而言,Active Directory 管理已不再是单一的运维任务,而是贯穿研发、生产与合规体系的基础能力。一套成熟的 AD 管理体系,既要满足严格的监管要求,也要支撑高效的业务协作,同时具备持续防御安全风险的能力。
ADManager Plus 通过将合规管控、账号自动化与安全防护整合于统一平台,帮助企业把分散、被动的 AD 管理方式,转化为标准化、可审计、可持续的身份治理体系。在研发周期不断压缩、合规要求持续提升的行业环境下,这种能力已成为生物制药企业信息化建设中不可或缺的基础工程。