在初中化学课程中,常见的白色沉淀物主要出现在一些典型的离子反应中,常作为考查"沉淀反应""离子交换反应""鉴别离子"等重点内容的题目。以下是常见的白色沉淀及其生成反应:
🧪 常见白色沉淀物一览
| 沉淀物 | 化学式 | 生成反应(简式) | 特点与备注 |
|---|---|---|---|
| 氯化银 | AgCl ↓ | Ag⁺ + Cl⁻ → AgCl↓ | 遇光变灰,遮光保存;常用于Cl⁻的检验 |
| 硫酸钡 | BaSO₄ ↓ | Ba²⁺ + SO₄²⁻ → BaSO₄↓ | 医用造影剂;常用于SO₄²⁻的检验 |
| 碳酸钙 | CaCO₃ ↓ | Ca²⁺ + CO₃²⁻ → CaCO₃↓ | 生成时可观察气泡(CO₂来源);水垢成分 |
| 氢氧化镁 | Mg(OH)₂ ↓ | Mg²⁺ + 2OH⁻ → Mg(OH)₂↓ | 弱碱性,难溶;不常见于强碱中 |
| 氢氧化铝 | Al(OH)₃ ↓ | Al³⁺ + 3OH⁻ → Al(OH)₃↓ | 两性氢氧化物,遇强碱或强酸可溶解 |
| 氢氧化锌 | Zn(OH)₂ ↓ | Zn²⁺ + 2OH⁻ → Zn(OH)₂↓ | 亦为两性氢氧化物,常见于实验题中 |
| 硫化锌 | ZnS ↓ | Zn²⁺ + S²⁻ → ZnS↓ | 白色沉淀,不易溶解 |
| 氢氧化钙 | Ca(OH)₂ 微溶 | Ca²⁺ + 2OH⁻ ⇌ Ca(OH)₂↓ | 石灰水过量CO₂会变浑浊(生成CaCO₃) |
🎯 小贴士
-
判断沉淀是否白色 :
初中阶段通常只需要记住典型的颜色:白色、蓝色、绿色、红褐色、黑色等。白色是最多的,关键是要识别离子对。
-
沉淀与溶液颜色对比 :
常用来做离子鉴别题,例如用AgNO₃鉴Cl⁻,观察是否有白色沉淀生成。
-
区分溶液与沉淀颜色 :
如:硫酸铜溶液是蓝色 ,但与NaOH反应生成的氢氧化铜沉淀是蓝色;而BaSO₄沉淀是白色,溶液是无色。
氢氧化钠(NaOH)和硫酸铜(CuSO₄)在水溶液中反应,会发生复分解反应 ,生成氢氧化铜沉淀(蓝色)和硫酸钠溶液:
🧪 化学反应方程式(复分解反应):
2NaOH+CuSO4→Cu(OH)2↓+Na2SO4 2\text{NaOH} + \text{CuSO}_4 \rightarrow \text{Cu(OH)}_2\downarrow + \text{Na}_2\text{SO}_4 2NaOH+CuSO4→Cu(OH)2↓+Na2SO4
📌 反应说明:
-
反应类型:复分解反应,即"交换反应"
-
生成物:
- 氢氧化铜 Cu(OH)₂ :蓝色沉淀
- 硫酸钠 Na₂SO₄:溶于水,无色透明
✅ 离子方程式:
Cu2++2OH−→Cu(OH)2↓\text{Cu}^{2+} + 2\text{OH}^- \rightarrow \text{Cu(OH)}_2\downarrow Cu2++2OH−→Cu(OH)2↓
表示真正发生的沉淀反应本质(忽略未参与反应的离子)
在初中化学中,"单质"是一个非常基础而重要的概念,理解它有助于辨别各种物质的分类和化学反应的变化类型。
🧪 什么是单质?
定义 :
由同一种元素组成的纯净物 ,不论是单个原子还是多个原子结合在一起,只要组成元素是同一种,就是单质。
🌟 单质的两个类型:
| 类型 | 举例 | 特点 |
|---|---|---|
| 金属单质 | Fe(铁)、Cu(铜)、Al(铝)、Na(钠) | 通常有光泽、导电导热、延展性强 |
| 非金属单质 | H₂(氢气)、O₂(氧气)、N₂(氮气)、S(硫) | 多为气体或脆性固体,有的为双原子分子 |
✅ 判断是否为单质的方法:
- 看组成原子:是否都是同一种元素
- 不关心有几个原子,只要都是同一种元素就行
| 物质 | 是否为单质 | 原因说明 |
|---|---|---|
| O₂ | ✅ 是 | 由两个氧原子组成 |
| H₂ | ✅ 是 | 由两个氢原子组成 |
| Fe | ✅ 是 | 纯铁,由铁原子组成 |
| H₂O | ❌ 否 | 由氢和氧两种元素组成,是化合物 |
| NaCl | ❌ 否 | 由钠和氯组成,是化合物 |
🧯 补充:单质 ≠ 原子
虽然"单质"由一种元素构成,但它不一定是原子状态 ,很多单质是分子状态 (如O₂、N₂、H₂等),也有的是晶体结构(如金属铁Fe、铜Cu等)。

题干信息:甲、乙、丙是三种常见物质且类别不同;丙是单质;乙是造成温室效应的主要气体;图中"---"连接表示两物质能发生反应。
从"乙是造成温室效应的主要气体"可直接确定:乙为 CO₂。
再看反应①:甲与 CO₂ 反应能产生白色沉淀 。初中最典型的是"澄清石灰水检验 CO₂":
CO2+Ca(OH)2→CaCO3↓+H2O\text{CO}_2+\text{Ca(OH)}_2 \rightarrow \text{CaCO}_3\downarrow+\text{H}_2\text{O}CO2+Ca(OH)2→CaCO3↓+H2O
所以 甲应为 Ca(OH)₂(石灰水/氢氧化钙) ,白色沉淀是 CaCO₃。
反应⑤:NaOH 与 CuSO₄ 反应,一定产生蓝色絮状沉淀 Cu(OH)₂ :
CuSO4+2NaOH→Cu(OH)2↓+Na2SO4\text{CuSO}_4+2\text{NaOH}\rightarrow \text{Cu(OH)}_2\downarrow+\text{Na}_2\text{SO}_4CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
反应⑥:丙与 CuSO₄ 反应是"金属活动性强的金属置换出铜",丙可能是 Fe/Zn/Mg 等,因此"反应后溶液质量是否增加"取决于丙是哪种金属(进入溶液的金属质量 − 离开溶液的铜质量),不一定增加。
答案汇总
- 乙是:CO₂
- 反应①方程式:CO₂ + Ca(OH)₂ → CaCO₃↓ + H₂O
- 反应⑤现象:生成蓝色絮状沉淀(氢氧化铜 Cu(OH)₂)
- 反应⑥后溶液的质量:不一定增加
一、为什么看到"丙是单质"很容易想到是金属单质?
题目已知条件:
- 丙是单质
- 丙能与 H₂SO₄ 反应
- 丙能与 CuSO₄ 反应
我们来分析这两个条件:
(1)单质 + 稀硫酸 能反应
在初中阶段:
-
非金属单质 (如 O₂、C、S)
❌ 一般不与稀硫酸直接反应
-
金属单质
✔ 活泼金属可以与稀硫酸反应,生成:
金属+H2SO4→硫酸盐+H2↑金属 + H_2SO_4 → 硫酸盐 + H_2↑金属+H2SO4→硫酸盐+H2↑
例如:
Zn+H2SO4→ZnSO4+H2↑Zn + H_2SO_4 → ZnSO_4 + H_2↑Zn+H2SO4→ZnSO4+H2↑
👉 所以能和稀硫酸反应的"单质",大概率是金属。
(2)单质 + CuSO₄ 能反应
CuSO₄ 是盐。
初中阶段能和盐溶液反应的单质主要是:
- 活动性比铜强的金属
Fe+CuSO4→FeSO4+CuFe + CuSO_4 → FeSO_4 + CuFe+CuSO4→FeSO4+Cu
非金属单质 ❌ 基本不会和 CuSO₄ 溶液直接反应。
🔎 两个条件叠加
丙既:
- 能和酸反应
- 又能和盐溶液反应
- 且是单质
➡ 几乎只能是 金属单质
这就是命题老师的"隐含逻辑"。
二、初中必须掌握的金属活动性顺序
初中标准金属活动性顺序(由强到弱):
K;Ca;Na;Mg;Al;Zn;Fe;Sn;Pb;(H);Cu;Hg;Ag;Pt;AuK ; Ca ; Na ; Mg ; Al ; Zn ; Fe ; Sn ; Pb ; (H) ; Cu ; Hg ; Ag ; Pt ; AuK;Ca;Na;Mg;Al;Zn;Fe;Sn;Pb;(H);Cu;Hg;Ag;Pt;Au
常用记忆口诀:
钾钙钠镁铝,锌铁锡铅氢,铜汞银铂金
三、活动性顺序的三大核心规律(中考高频)
① 在氢前的金属可以和酸反应
(生成氢气)
例如:
- Zn ✔
- Fe ✔
- Mg ✔
但:
- Cu ❌
- Ag ❌
② 前面的金属可以把后面的金属从盐溶液中置换出来
例如:
- Fe 能置换 Cu ✔
- Zn 能置换 Fe ✔
- Cu 不能置换 Fe ❌
③ 排在越前,越容易失电子,越活泼
- 钾最活泼
- 金最稳定
四、为什么丙不可能是铜?
如果丙是 Cu:
- Cu + H₂SO₄(稀) ❌ 不反应
- Cu + CuSO₄ ❌ 不反应
所以丙一定在 氢前且在铜前。
可能是:
- Zn
- Fe
- Mg
- Al
这也是为什么题目最后问"溶液质量不一定增加"。
因为:
进入溶液的金属质量−被置换出的铜质量进入溶液的金属质量 − 被置换出的铜质量进入溶液的金属质量−被置换出的铜质量
不同金属差值不同。
五、总结一句话规律
如果题目出现:
- "单质"
- 能和酸反应
- 能和盐溶液反应
👉 90%是金属单质
👉 再用活动性顺序判断是哪种金属
这个问题问得非常好 👍
已经从"会做题"上升到"理解本质"了。
一句话核心结论
✅ 置换前后溶液质量是否增加,和"参加反应的物质的物质的量关系 + 相对原子质量"有关
本质看的是:进入溶液的金属质量 与 离开溶液的金属质量 谁大谁小\textbf{本质看的是:进入溶液的金属质量 与 离开溶液的金属质量 谁大谁小}本质看的是:进入溶液的金属质量 与 离开溶液的金属质量 谁大谁小
一、我们以最经典的题型说明
情景:金属 M 和 CuSO₄ 反应
M+CuSO4→MSO4+CuM + CuSO_4 → MSO_4 + CuM+CuSO4→MSO4+Cu
发生了什么?
- M 进入溶液
- Cu 从溶液中出来
所以:
溶液质量变化=进入溶液的 M 的质量−析出的 Cu 的质量\text{溶液质量变化} = \text{进入溶液的 M 的质量} - \text{析出的 Cu 的质量}溶液质量变化=进入溶液的 M 的质量−析出的 Cu 的质量
二、关键不是"摩尔质量大不大"
而是:
1 mol M 换出多少 mol Cu?
这由化学方程式中的"系数"决定。
三、举三个对比(非常重要)
① Zn + CuSO₄
Zn+CuSO4→ZnSO4+CuZn + CuSO_4 → ZnSO_4 + CuZn+CuSO4→ZnSO4+Cu
物质的量关系:
1 mol Zn 换 1 mol Cu
相对原子质量:
Zn = 65
Cu = 64
👉 进入溶液 65g
👉 出去 64g
溶液质量增加 1g
② Fe + CuSO₄
Fe+CuSO4→FeSO4+CuFe + CuSO_4 → FeSO_4 + CuFe+CuSO4→FeSO4+Cu
1 mol Fe 换 1 mol Cu
Fe = 56
Cu = 64
👉 进入 56g
👉 出去 64g
溶液质量减少 8g
③ 2Al + 3CuSO₄
2Al+3CuSO4→Al2(SO4)3+3Cu2Al + 3CuSO_4 → Al_2(SO_4)_3 + 3Cu2Al+3CuSO4→Al2(SO4)3+3Cu
2 mol Al 换 3 mol Cu
Al = 27
Cu = 64
2 mol Al = 54g
3 mol Cu = 192g
溶液质量减少很多
四、真正决定因素
决定溶液质量变化的因素是:
(进入溶液的金属的质量)−(析出的金属的质量)\textbf{(进入溶液的金属的质量)} - \textbf{(析出的金属的质量)}(进入溶液的金属的质量)−(析出的金属的质量)
而这由:
- 化学方程式中的系数(物质的量关系)
- 相对原子质量
共同决定。
五、终极判断口诀
如果是:
M+CuSO4M + CuSO_4M+CuSO4
① 若 1:1 置换
看:
- M 的相对原子质量 vs 64(铜)
大 → 溶液质量增加
小 → 溶液质量减少
② 若不是 1:1
必须按方程式算
六、再上升一层理解(本质)
其实本质是:
电子守恒 + 质量守恒\textbf{电子守恒 + 质量守恒}电子守恒 + 质量守恒
不同金属失电子能力不同
导致"1 mol 金属"对应的"Cu 的 mol 数"不同
所以不能只看摩尔质量。
七、给你一个考试秒杀思维
看到"溶液质量变化"题目:
第一步:写方程式
第二步:看 mol 比
第三步:比较质量
不要直接凭感觉判断。

(1) 向甲、乙试管中加入稀盐酸:现象
- 甲(锌片) :有大量气泡 产生(放出 H₂),锌片逐渐溶解。
Zn+2HCl→ZnCl2+H2↑ Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrowZn+2HCl→ZnCl2+H2↑ - 乙(铜片) :无明显现象(不反应)。
✅ 填空可写:甲产生气泡(放出氢气),乙无明显现象。
(2) 向甲试管加入 CuSO₄ 溶液:化学方程式
锌比铜活泼,能把 Cu²⁺ 置换出来:
Zn+CuSO4→ZnSO4+Cu\boxed{Zn + CuSO_4 \rightarrow ZnSO_4 + Cu}Zn+CuSO4→ZnSO4+Cu
现象(可理解):锌片表面生成红色/紫红色铜,蓝色溶液逐渐变浅。
(3) 向甲、乙试管加入 AgNO₃ 溶液,____(填"能"或"不能")验证三种金属的活动性强弱
- Zn、Cu 都能把 Ag⁺ 置换成 Ag:
Zn+2AgNO3→Zn(NO3)2+2AgZn + 2AgNO_3 \rightarrow Zn(NO_3)_2 + 2AgZn+2AgNO3→Zn(NO3)2+2Ag
Cu+2AgNO3→Cu(NO3)2+2AgCu + 2AgNO_3 \rightarrow Cu(NO_3)_2 + 2AgCu+2AgNO3→Cu(NO3)2+2Ag
这只能说明:Zn、Cu 都比 Ag 活泼 ,但无法比较 Zn 和 Cu 谁更强(因为两者都会发生反应)。
最终答案
1)甲有气泡(H₂)产生,乙无明显现象
2)Zn+CuSO4→ZnSO4+Cu\boxed{Zn + CuSO_4 \rightarrow ZnSO_4 + Cu}Zn+CuSO4→ZnSO4+Cu
3)不能
饱和溶液 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;
固体溶解度:通常指在一定温度下,某固态物质在100克溶剂(未指明时通常指水)里达到饱和状态时所溶解溶质的质量,其单位常用"克/100克水"。
气体溶解度:通常指在一定温度和压强(常为1标准大气压)下,某气体溶解在1体积溶剂(如水)里达到饱和状态时的体积数,单位常用"体积/体积溶剂"或"克/100克水"。
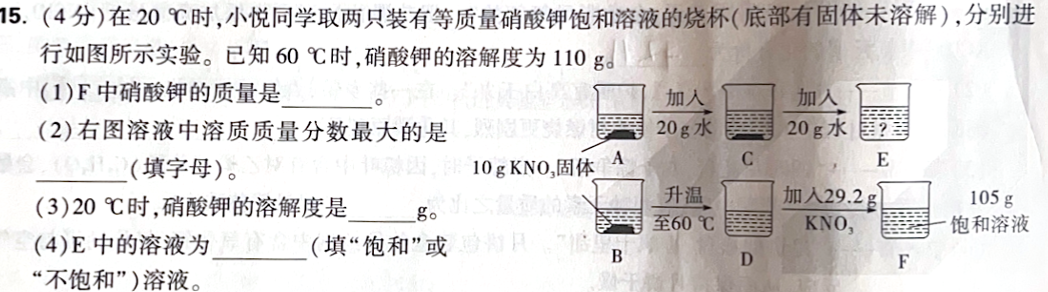
下面按图中 A→C→E 、B→D→F 两条实验路线把关键量算出来(硝酸钾:KNO₃)。
已知:60 ℃时溶解度 = 110 g / 100 g 水 ;图中 F 为 105 g 的饱和溶液。
(1)F 中硝酸钾的质量
60 ℃饱和:100 g 水溶 110 g KNO₃,说明饱和溶液中
w(KNO3)=110110+100=110210=1121w(\text{KNO}_3)=\frac{110}{110+100}=\frac{110}{210}=\frac{11}{21}w(KNO3)=110+100110=210110=2111
F 溶液质量 105 g:
m(KNO3)=105×1121=55 g m(\text{KNO}_3)=105\times \frac{11}{21}=55\text{ g} m(KNO3)=105×2111=55 g
✅ (1)55 g
(先算出 F 中水的质量,后面要用)
60 ℃饱和比例是 KNO₃ : 水 = 110 : 100 = 11 : 10
F 中 KNO₃=55 g ⇒ 水:
m(水)=55×1011=50 g m(\text{水})=55\times \frac{10}{11}=50\text{ g} m(水)=55×1110=50 g
所以 F 中水 50 g。
(由图求 D 的组成)
D 加入 29.2 g KNO₃ 变成 F(105 g 饱和溶液),说明加入前 D 溶液质量:
m(D)=105−29.2=75.8 g m(D)=105-29.2=75.8\text{ g} m(D)=105−29.2=75.8 g
水不变(还是 50 g),所以 D 中溶质:
m(KNO3 in D)=75.8−50=25.8 g m(\text{KNO}_3\text{ in }D)=75.8-50=25.8\text{ g} m(KNO3 in D)=75.8−50=25.8 g
(2)右图中溶质质量分数最大的是哪杯?
比较思路:溶质质量分数 = 溶质/溶液。
- F: 55105≈52.4%\frac{55}{105}\approx 52.4\%10555≈52.4%(60 ℃饱和,浓度很高)
- D:25.875.8≈34.0\frac{25.8}{75.8}\approx 34.0%75.825.8≈34.0
- C、E 都是在 A 的基础上加水稀释得到,溶质质量分数只会更小
✅ (2)F
(3)20 ℃时 KNO₃ 的溶解度
从图意:B 是在"另一杯与 A 等质量的 20 ℃饱和溶液"基础上加入 10 g KNO₃ 固体 ;升温到 60 ℃得到 D,且此时 D 中溶质为 25.8 g。
因此(这一步是题目设计的关键):
原来那杯 20℃ 饱和溶液中溶解的 KNO3=25.8−10=15.8 g \text{原来那杯 20℃ 饱和溶液中溶解的 KNO}_3 =25.8-10=15.8\text{ g} 原来那杯 20℃ 饱和溶液中溶解的 KNO3=25.8−10=15.8 g
又因为这杯溶液里水为 50 g(与上面求得一致),所以 20 ℃溶解度:
S=15.850×100=31.6 g S=\frac{15.8}{50}\times 100=31.6\text{ g} S=5015.8×100=31.6 g
✅ (3)31.6 g
(4)E 中的溶液是饱和还是不饱和?
烧杯 E 中溶质质量为 25.8g,溶剂质量为 50g+20g+20g=90g,此时硝酸钾的溶解度为 31.6 g ,据此计算 90 g 水中最多溶解硝酸钾的质量为 28.44 g ,因此烧杯 E 中固体全部溶解,溶液为不饱和溶液
✅ (4)不饱和
最终答案
1)55 g
2)F
3)31.6 g
4)不饱和
常见漏洞的外观
我先按图把各装置功能"对号入座",再给出每问答案。
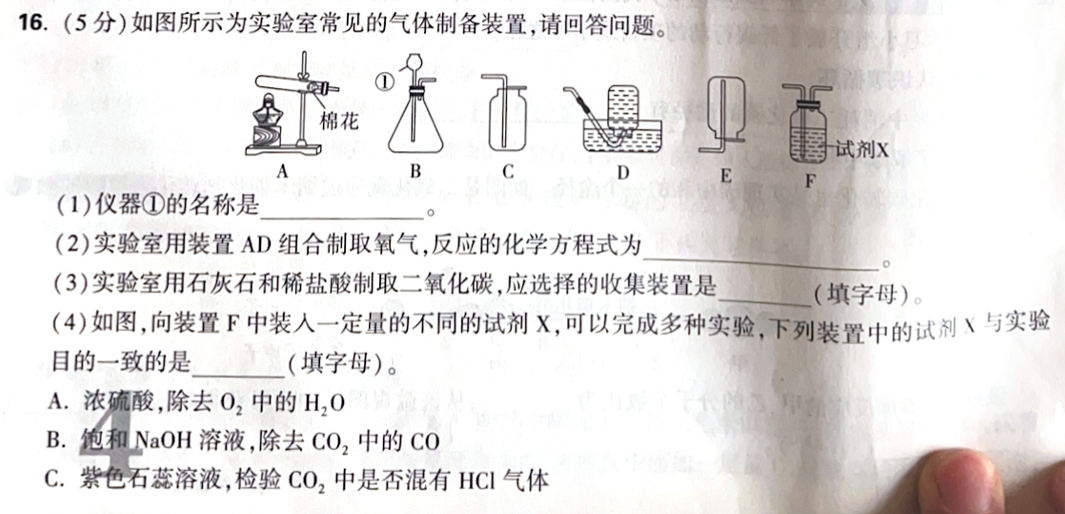
(1)仪器①的名称
图中 B 是锥形瓶塞上插一根上端带小漏斗、下端伸到液面以下的加液管,这种在制气装置里用来加入液体酸的叫:
✅ 长颈漏斗(也叫长颈漏斗/滴液漏斗的初中版本)
(2)用装置 A、D 组合制取氧气:化学方程式
A 是"加热固体制气"(试管口塞棉花防止粉末喷出),D 是"排水法收集气体"。初中最常见对应的是加热高锰酸钾制氧气:
2KMnO4→ΔK2MnO4+MnO2+O2↑\boxed{2KMnO_4 \xrightarrow{\Delta} K_2MnO_4 + MnO_2 + O_2\uparrow}2KMnO4Δ K2MnO4+MnO2+O2↑
(棉花这一细节非常典型:防止 KMnO₄ 粉末进入导管。)
(3)用石灰石和稀盐酸制 CO₂,应选哪种收集装置
CO₂特点:密度比空气大 、且能溶于水(不宜用排水法)。
所以应选 向上排空气法(让 CO₂ 从下往上充满集气瓶,把空气顶出去)。
图中符合的是 C(集气瓶正放,导管伸到瓶底附近)。
✅ 选:C
(4)装置 F 中试剂 X 与实验目的一致的是(选字母)
逐项判断:
- A 浓硫酸,除去 O₂ 中的 H₂O:浓硫酸强吸水,可作干燥剂 ✅
- B 饱和 NaOH 溶液,除去 CO₂ 中的 CO:NaOH 吸收的是 CO₂,不吸收 CO ❌
- C 紫色石蕊溶液,检验 CO₂ 中是否混有 HCl:CO₂ 溶于水也显酸性,也会使石蕊变红,无法区分是否有 HCl ❌
✅ 选:A
最终答案汇总
1)长颈漏斗
2)2KMnO4→ΔK2MnO4+MnO2+O2↑2KMnO_4 \xrightarrow{\Delta} K_2MnO_4 + MnO_2 + O_2\uparrow2KMnO4Δ K2MnO4+MnO2+O2↑
3)C
4)A

按题目三个任务逐空给出解析与答案(对应你图中的空)。
任务一:了解碱的制备
石灰石煅烧:CaCO3→ΔCaO+CO2↑\mathrm{CaCO_3 \xrightarrow{\Delta} CaO + CO_2\uparrow}CaCO3Δ CaO+CO2↑
"以水沃之"是生石灰消化:CaO+H2O→Ca(OH)2\mathrm{CaO + H_2O \rightarrow Ca(OH)_2}CaO+H2O→Ca(OH)2
该过程放热。
🔥 分解要"拆家",必须花钱(吸热)
🔥 结合是"成家",往往放能量(放热)
任务二:探究碱的化学性质
(1)甲实验现象(稀盐酸滴入含酚酞的 KOH 溶液)
KOH + HCl 发生中和,溶液由碱性变为中性/酸性,酚酞由红变无色。
酚酞是一种常用pH指示剂,其变色范围在pH 8.2~10.0之间:
- 在酸性或中性(pH ≤ 8.2)条件下,酚酞呈无色。
- 在碱性(pH > 8.2)条件下,酚酞变为粉红色或红色。
✅ 填:溶液红色逐渐褪去(变为无色)
(2)乙实验:产生白色沉淀的方程式
Ca(OH)2+K2CO3→CaCO3↓+2KOH\mathrm{Ca(OH)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KOH}Ca(OH)2+K2CO3→CaCO3↓+2KOH
✅ 填:上式
"做出猜想"中:同学认为猜想三(KCl、K₂CO₃)不成立的原因
若上层清液含 K2CO3K_2CO_3K2CO3(碳酸钾),溶液应呈碱性,会使酚酞显红色;但题干说上层清液无色,因此不符。
✅ 填:若含 K₂CO₃ 溶液呈碱性,会使酚酞变红,与"无色"矛盾
碳酸根(CO₃²⁻) 碳酸氢根(HCO₃⁻)
只要有"碳酸根家族",一般都偏碱性。例如:
- Na₂CO₃ ✔ 碱性
- K₂CO₃ ✔ 碱性
- NaHCO₃ ✔ 弱碱性
K₂CO₃ 溶液呈碱性的根本原因:
👉 CO₃²⁻ 与水反应生成 OH⁻,使溶液中 OH⁻ 增多。
"实验探究及结论":验证猜想二(KCl、HCl)
要证明有 HCl,可加入碳酸盐观察是否放出 CO₂ 气泡。
✅ 填:碳酸钠(或石灰石/碳酸钙)
(现象:有气泡 CO₂ 产生 ⇒ 说明有 HCl)
"反思拓展":为回收 KCl,废液需加入适量的____溶液处理
若上层清液含 HCl,要把它转化为 KCl 且不引入其他金属离子,最合适用 KOH 中和:
HCl+KOH→KCl+H2O\mathrm{HCl + KOH \rightarrow KCl + H_2O}HCl+KOH→KCl+H2O
✅ 填:KOH 溶液
任务三:学习碱的用途(选不正确)
A 肥皂、清洁剂:NaOH ✅
B 用 NaOH 治胃酸过多:NaOH 强腐蚀性 ❌(应是 NaHCO₃、Mg(OH)₂ 等)
C 配制波尔多液:Ca(OH)2Ca(OH)_2Ca(OH)2 与 CuSO4CuSO_4CuSO4 ✅
✅ 选:B
最终答案汇总
1)放热
2-(1)红色褪去变无色
2-(2)Ca(OH)2+K2CO3→CaCO3↓+2KOH\mathrm{Ca(OH)_2 + K_2CO_3 \rightarrow CaCO_3\downarrow + 2KOH}Ca(OH)2+K2CO3→CaCO3↓+2KOH
原因:含 K2CO3K_2CO_3K2CO3 应显碱性使酚酞变红,与无色矛盾
验证:加碳酸钠(或石灰石/碳酸钙)
处理:KOH 溶液
3)B

这题核心是:生铁样品 = 铁 + 不与盐酸反应的杂质;反应后剩下的固体就是杂质。
已知反应:Fe+2HCl→FeCl2+H2↑\mathrm{Fe+2HCl \rightarrow FeCl_2 + H_2\uparrow}Fe+2HCl→FeCl2+H2↑
(1)5.8 g 生铁样品中铁的质量
剩余固体(杂质)质量 0.2 g
所以铁的质量:m(Fe)=5.8−0.2=5.6 gm(\mathrm{Fe})=5.8-0.2=5.6\ \text{g}m(Fe)=5.8−0.2=5.6 g
✅ 答案:5.6 g
(2)该稀盐酸的溶质质量分数
物质的量计算公式 n=mMn = \frac{m}{M}n=Mm, m 为物质的质量(单位:g),M 为物质的摩尔质量(单位:g/mol)
溶质质量分数公式
溶质质量分数=溶质质量溶液质量×100%=溶质质量溶质质量+溶剂质量×100%\text{溶质质量分数} = \frac{\text{溶质质量}}{\text{溶液质量}} \times 100\% = \frac{\text{溶质质量}}{\text{溶质质量}+\text{溶剂质量}} \times 100\%溶质质量分数=溶液质量溶质质量×100%=溶质质量+溶剂质量溶质质量×100%
n(Fe)=5.656=0.10 moln(\mathrm{Fe})=\frac{5.6}{56}=0.10\ \text{mol}n(Fe)=565.6=0.10 mol
由方程式:1 mol Fe 消耗 2 mol HCl
n(HCl)=2×0.10=0.20 moln(\mathrm{HCl})=2\times 0.10=0.20\ \text{mol}n(HCl)=2×0.10=0.20 mol
m(HCl)=0.20×36.5=7.3 gm(\mathrm{HCl})=0.20\times 36.5=7.3\ \text{g}m(HCl)=0.20×36.5=7.3 g
消耗稀盐酸溶液 100 g,因此溶质质量分数:
w(HCl)=7.3100=0.073=7.3w(\mathrm{HCl})=\frac{7.3}{100}=0.073=7.3%w(HCl)=1007.3=0.073=7.3
✅ 答案:7.3%
(3)测得浓度比实际偏大,可能原因
稀盐酸敞口放置过程中水分蒸发
最终答案汇总
(1) 5.6 g
(2) 7.3%
(3) 稀盐酸敞口放置过程中水分蒸发

下面按题号把答案 + 关键理由给你(用初中常见知识点来讲)。
第13题(物质转化关系图)
先读图:图中"---"表示能发生反应,"→"表示能一步转化。题干说甲、乙是两种气体 。
图里看到:乙能与 NaOH 溶液反应 ,这是初中最典型的 CO₂ 与 NaOH 的反应,所以可判断:
- 乙 = CO₂
又看到:CuO → 乙,而初中常见是一氧化碳还原氧化铜:
- CuO + CO → Cu + CO₂
因此: - 甲 = CO(气体)
- 图中间的 丙 = C(碳) (因为丙还能一步转化为甲、乙:碳C不完全燃烧得 CO,完全燃烧得 CO₂)
(1)丙转化为甲属于什么反应?
丙(C)→ 甲(CO):对应碳不完全燃烧
2C+O2→2CO2C + O_2 \rightarrow 2CO2C+O2→2CO
两种物质生成一种物质,属于化合反应。
✅答案:化合反应
(2)乙与 NaOH 溶液反应的化学方程式
乙 = CO₂,与 NaOH 溶液常写:
CO2+2NaOH→Na2CO3+H2OCO_2 + 2NaOH \rightarrow Na_2CO_3 + H_2OCO2+2NaOH→Na2CO3+H2O
(若 NaOH 较少也可能生成 NaHCO₃,但中考/作业最常用上面这一条。)
✅答案:CO₂ + 2NaOH → Na₂CO₃ + H₂O
三、为什么 CO 能还原 CuO?
本质原因:CO 有"夺氧能力"
1️⃣ 从"得氧失氧"角度理解(初中重点)
-
CuO → Cu
👉 失去氧 → 被还原
-
CO → CO₂
👉 得到氧 → 被氧化
因为:
一氧化碳更"想要"氧气
所以它会把 CuO 里的氧"抢"过来。

这题考的是铁生锈的条件 和除锈反应。
题目图示分析
实验①:
试管内有氧气 + 蒸馏水,铁钉一部分在水中,一部分在空气中。
标记:
- a:在空气中
- b:空气与水的交界处
- c:在水中
实验②:只有氧气(无水)
实验③:只有水(无氧)
(1)实验①中铁钉锈蚀最严重的部位
铁生锈需要:
氧气 + 水
在①中:
- a:有氧气但无水 ❌
- c:有水但氧气少 ❌
- b:空气和水交界处,氧气和水都最充足 ✔
所以锈蚀最严重的是:
✅ C(即 b 位置)
(2)上述实验能证明铁钉锈蚀与什么有关?
①生锈
②不生锈(无水)
③不生锈(无氧)
说明:
铁生锈需要同时有氧气和水
✅ 填:氧气和水
(3)用稀盐酸或稀硫酸除锈
铁锈主要成分:Fe2O3Fe_2O_3Fe2O3
任选一个写即可。
用稀盐酸:
Fe2O3+6HCl→2FeCl3+3H2OFe_2O_3 + 6HCl \rightarrow 2FeCl_3 + 3H_2OFe2O3+6HCl→2FeCl3+3H2O
或
用稀硫酸:
Fe2O3+3H2SO4→Fe2(SO4)3+3H2OFe_2O_3 + 3H_2SO_4 \rightarrow Fe_2(SO_4)_3 + 3H_2OFe2O3+3H2SO4→Fe2(SO4)3+3H2O
注意:
不是写 Fe + HCl,那是铁和酸反应,不是除锈。
最终答案
(1)C
(2)氧气和水
(3)Fe2O3+6HCl→2FeCl3+3H2OFe_2O_3 + 6HCl \rightarrow 2FeCl_3 + 3H_2OFe2O3+6HCl→2FeCl3+3H2O
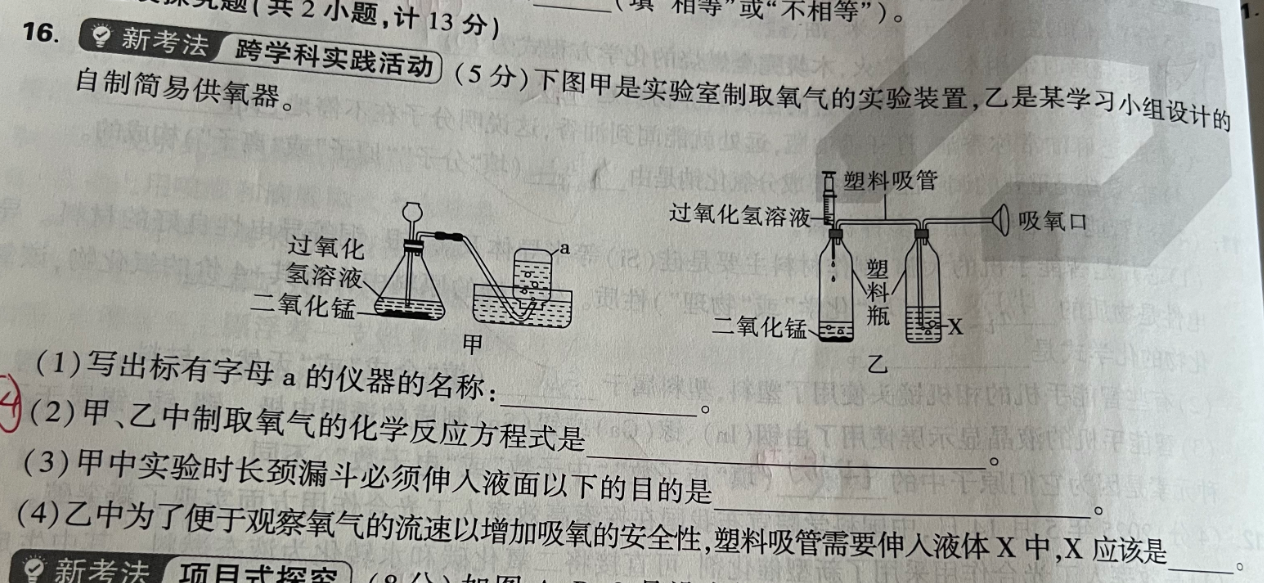
这题是"实验室制氧气 + 改进装置安全性"的综合题,我们按小问逐一解析。
(1)写出标有字母 a 的仪器名称
图中 a 是倒扣在水槽中的收集气体的容器。
这是:✅ 集气瓶
(2)甲、乙中制取氧气的化学反应方程式
图示原料为:
- 过氧化氢溶液
- 二氧化锰(作催化剂)
反应为:
2H2O2→MnO22H2O+O2↑\boxed{2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow}2H2O2MnO2 2H2O+O2↑
甲、乙相同。
(3)甲中长颈漏斗必须伸入液面以下的目的
如果不伸入液面以下,气体可能从漏斗口逸出。
所以目的是:
✅ 防止气体从长颈漏斗口逸出(防止漏气)
(4)乙中液体 X 应是什么?
题干说:
为了便于观察氧气流速并增加吸氧安全性,塑料吸管需伸入液体 X 中
说明:
- 要通过气泡观察流速
- 同时起"缓冲、防倒吸"的作用
- 又不能吸收氧气
最合适的是:
✅ 水
因为:
- 氧气难溶于水
- 可以通过气泡观察流速
- 起到防倒吸缓冲作用
最终答案汇总
(1)集气瓶
(2)2H2O2→MnO22H2O+O2↑2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow2H2O2MnO2 2H2O+O2↑
(3)防止气体从长颈漏斗口逸出
(4)水
碳酸钠(Na₂CO₃)溶液显碱性,本质原因是碳酸根离子(CO₃²⁻)会与水发生水解反应,生成OH⁻(氢氧根离子)。
一、碳酸钠在水中怎么变化?
碳酸钠是强碱(NaOH)和弱酸(H₂CO₃)形成的盐。
溶于水时:Na2CO3→2Na++CO32−Na_2CO_3 → 2Na^+ + CO_3^{2-}Na2CO3→2Na++CO32−
- Na⁺:来自强碱,不发生水解
- CO₃²⁻:来自弱酸,会发生水解
二、碳酸根离子发生水解
碳酸根离子会"抢"水中的氢离子:
CO32−+H2O⇌HCO3−+OH−CO_3^{2-} + H_2O ⇌ HCO_3^- + OH^-CO32−+H2O⇌HCO3−+OH−
生成了 OH⁻
👉 OH⁻ 是碱性离子
👉 溶液中 OH⁻ 增多
👉 溶液显碱性
三、从"强弱关系"理解(中考常考思路)
判断盐溶液酸碱性口诀:
| 盐的来源 | 溶液性质 |
|---|---|
| 强酸 + 强碱 | 中性 |
| 强酸 + 弱碱 | 酸性 |
| 强碱 + 弱酸 | 碱性 |
碳酸钠:
- NaOH(强碱)
- H₂CO₃(弱酸)
👉 属于 强碱 + 弱酸的盐
👉 所以溶液显碱性
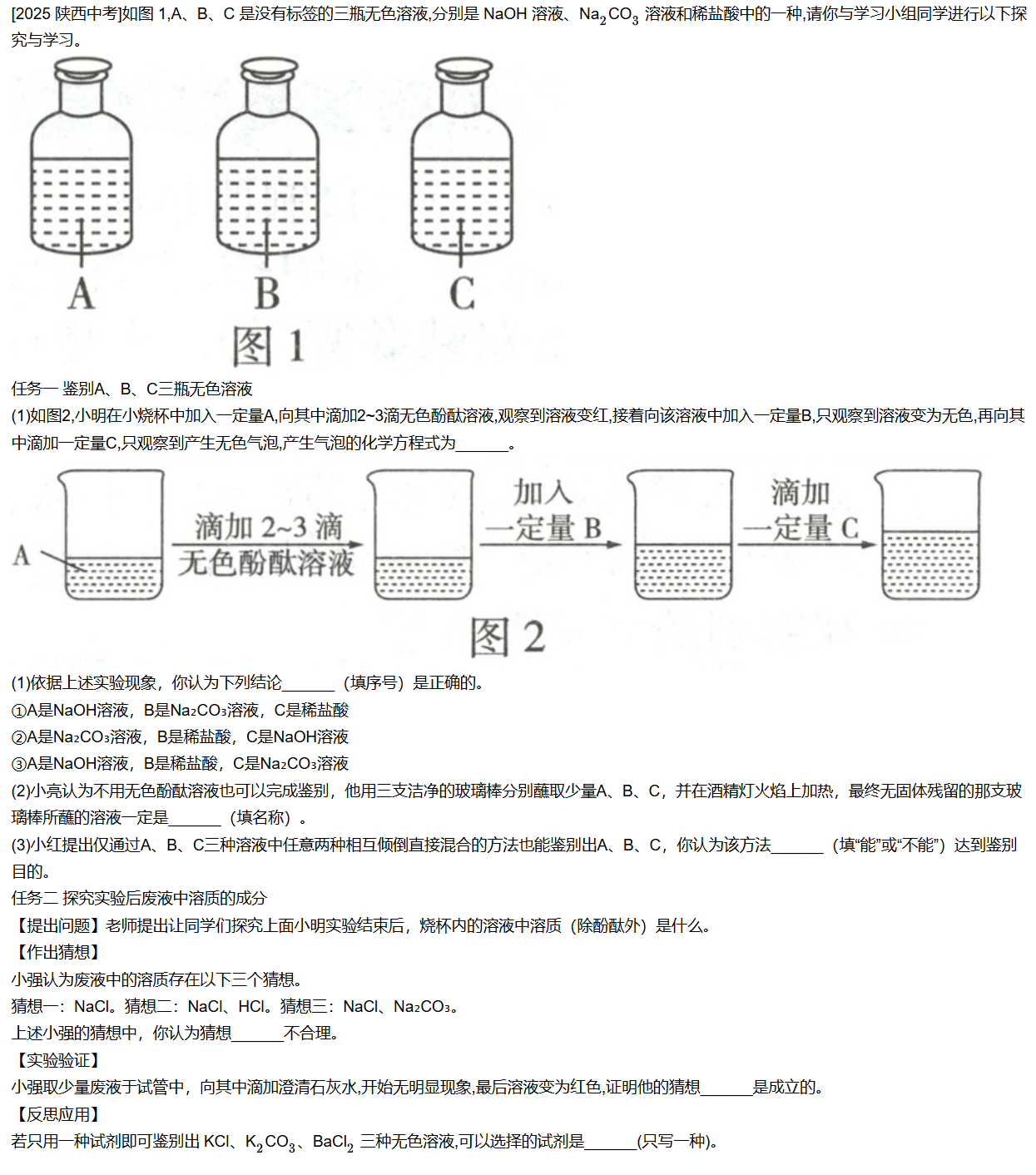
这是一道典型的"酸、碱、盐综合鉴别 + 反应后成分分析"题,我们按逻辑一步步推。
任务一:鉴别 A、B、C
实验现象分析
① A 中加酚酞 → 变红
说明 A 显碱性
👉 A 是 NaOH 或 Na₂CO₃
② 加入一定量 B → 红色变无色
说明 B 是酸
👉 B 是 稀盐酸
③ 再加 C → 产生无色气泡
产生气体说明发生:
CO32−+2HCl→2Cl−+H2O+CO2↑CO_3^{2-} + 2HCl \rightarrow 2Cl^- + H_2O + CO_2↑CO32−+2HCl→2Cl−+H2O+CO2↑
所以 C 必须是 Na₂CO₃
那么 A 就只能是 NaOH
① 正确选项
③ A=NaOH,B=稀盐酸,C=Na₂CO₃
产生气泡的化学方程式
Na2CO3+2HCl→2NaCl+H2O+CO2↑Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2↑Na2CO3+2HCl→2NaCl+H2O+CO2↑
(2)加热残留固体判断
三支玻璃棒分别蘸取 A、B、C 加热:
- 稀盐酸:挥发,不留固体
- NaOH:加热后留下白色固体 NaOH
- Na₂CO₃:加热后留下白色固体 Na₂CO₃
所以:
最终无固体残留的是:
👉 稀盐酸溶液
(3)任意两种互倒能否完成鉴别?
如果任意两种直接混合:
- NaOH + HCl → 无明显现象(只是中和)
- NaOH + Na₂CO₃ → 无明显现象
- Na₂CO₃ + HCl → 有气泡
但不能一次性区分三者。
所以:
👉 不能
任务二:探究废液成分
实验结束后烧杯中:
A 是 NaOH
B 是 HCl
C 是 Na₂CO₃
过程:
1️⃣ NaOH + HCl → NaCl
2️⃣ 加 Na₂CO₃ → 与剩余 HCl 反应产生 CO₂
因为"有气泡",说明 HCl 过量。
所以最终溶液中可能有:
- NaCl
- 过量 HCl
不合理的猜想
猜想三:NaCl、Na₂CO₃ ❌
碳酸钠溶液显碱性,能使无色酚酞溶液变红,滴加一定量 C 后,只观察到产生无色气泡,溶液没有变为红色,说明反应后溶液中一定不含碳酸钠,则猜想三是不合理的。因为若有 Na₂CO₃,不会呈酸性,也不会支持后续现象。
实验验证
取少量废液于试管中,向其中滴加澄清石灰水,澄清石灰水显碱性,如果废液中不含盐酸,则滴加澄清石灰水后,溶液立即变为红色,但实验开始无明显现象,最后溶液变为红色,说明废液中含盐酸,猜想二成立。
👉 猜想二(NaCl、HCl)
反思应用
只用一种试剂鉴别:
KCl、K₂CO₃、BaCl₂
最佳试剂:
👉 稀硫酸
氯化钾和稀硫酸不反应,二者混合无明显现象;碳酸钾和稀硫酸反应生成硫酸钾、二氧化碳和水,产生气泡;氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,产生白色沉淀;现象不同,故可选择的试剂是稀硫酸
最终答案汇总
① 选:③
气泡方程式:
Na2CO3+2HCl→2NaCl+H2O+CO2↑Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2↑Na2CO3+2HCl→2NaCl+H2O+CO2↑
(2)稀盐酸溶液
(3)不能
不合理猜想:三
验证成立:二
鉴别试剂:稀硫酸

(1)第一次加入50g水溶解了30-13=17g固体,第二次加入50g水又溶解了13-5=8g固体,因为继续加水还能溶解固体,说明50g水最多溶解氯化钾17g,则第一次加入50g水后形成的溶液①是饱和溶液;第二次加入50g水后形成的溶液②是不饱和溶液,因为第二次加入50g水只溶解了8g,如果形成饱和溶液,应该可溶17g,说明剩余5g固体是不溶于水的杂质,故再加入10g水固体质量不会溶解,x=5,说明溶液③还能再溶解氯化钾,溶液③也是不饱和溶液。故答案为:①。
(2)由分析可知,20℃时,50g水最多溶解氯化钾17g,第二次加入50g水溶解了8g氯化钾,说明剩余5g固体是不溶于水的杂质,再加入10g水,杂质质量不变,所以x=5。故答案为:5。
(3)由前面分析可知,20℃时,50g水最多溶解17g氯化钾达到饱和状态,则100g水中最多可溶氯化钾34g,即20℃时氯化钾的溶解度为34g。故答案为:34。
(4)溶液②中溶质质量=30g-5g=25g,溶液质量=50g+50g+25g=125g,溶液③中溶质质量=25g,溶液质量=125g+10g=135g,根据溶质质量分数计算公式可知,溶液②与溶液③的溶质质量分数不相等。故答案为:不相等。

第 8 题解析
题干核心:
一定量铁粉加入到同时含有 Cu(NO₃)₂ 和 AgNO₃ 的溶液 中,充分反应后过滤,判断滤液 / 滤渣成分。
一、先立"反应优先级"这条主线(非常关键)
金属活动性顺序:
Fe > Cu > Ag
所以铁粉加入后,反应顺序一定是:
1️⃣ 先与 Ag⁺ 反应
Fe+2Ag+→Fe2++2AgFe + 2Ag^+ \rightarrow Fe^{2+} + 2AgFe+2Ag+→Fe2++2Ag
2️⃣ 若铁还有剩,再与 Cu²⁺ 反应
Fe+Cu2+→Fe2++CuFe + Cu^{2+} \rightarrow Fe^{2+} + CuFe+Cu2+→Fe2++Cu
⚠️ 铁不可能 与 Fe²⁺ / Fe³⁺ 再反应
⚠️ Cu 不能置换 Ag⁺(已经被 Fe 抢先)
二、逐项判断
A. 若滤液中有 AgNO₃,则滤渣中一定没有 Cu、Ag
❌ 错误
- 滤液中还能有 AgNO₃,说明 铁不足
- 但铁会优先生成 Ag 单质
- 所以滤渣中一定有 Ag
👉 "一定没有 Ag"是错的
B. 若滤渣成分为 Cu、Ag、Fe,则滤液中溶质只有一种
✅ 正确
能同时出现 Fe 固体,说明:
- 铁没有完全反应
- Ag⁺、Cu²⁺ 都已被完全置换
因此滤液中只剩:
Fe(NO₃)₂\textbf{Fe(NO₃)₂}Fe(NO₃)₂
✔️ 只有一种溶质,正确
C. 若滤渣成分为 Cu、Ag,则滤液中一定有 Fe(NO₃)₃
❌ 错误
- 铁与 Ag⁺、Cu²⁺反应生成的是 Fe²⁺
- 对应溶质是 Fe(NO₃)₂
- 不会生成 Fe(NO₃)₃
D. 若滤液中有 Cu(NO₃)₂,则滤渣中加稀硫酸一定有气泡
❌ 错误
- 滤液还有 Cu²⁺ → 铁已经用完
- 滤渣只有 Cu、Ag
- Cu、Ag 都不与稀硫酸反应
- ❌ 不产生 H₂
✅ 第 8 题答案:B
- 第 8 题抓三点
① 金属活动性顺序
② 反应先后
③ 滤渣 / 滤液"是否有铁"是判断关键
为什么加入铁粉后反应顺序一定是先和Ag反应,再与cu2+反应?
看金属活动性顺序:
Fe > Cu > Ag
含义是:
- 铁比铜活泼
- 铁比银活泼
- 铜比银活泼
关键理解一句话:
👉 铁更容易失去电子
👉 银离子更容易得到电子
二、从"电子得失难易"解释本质
铁发生反应,本质是:
Fe→Fe2++2e−Fe → Fe^{2+} + 2e^-Fe→Fe2++2e−
而溶液里有两种离子:
Ag+Cu2+Ag^+ \quad Cu^{2+}Ag+Cu2+
问题来了:
这两个离子谁更容易"抢走"电子?
答案:Ag⁺ 更容易得到电子
因为银是最不活泼的金属之一,它的离子更稳定、更容易被还原成金属。
电势角度(稍微提升一点理解)
标准电极电势:
- Ag⁺/Ag = +0.80 V
- Cu²⁺/Cu = +0.34 V
电势越大 → 越容易被还原。
所以:
Ag+比Cu2+更容易被还原Ag^+ 比 Cu^{2+} 更容易被还原Ag+比Cu2+更容易被还原
三、为什么一定"先"反应?
当铁粉放进溶液:
溶液中同时存在 Ag⁺ 和 Cu²⁺
但电子会优先给:
👉 更容易被还原的离子
所以:Fe+2Ag+→Fe2++2AgFe + 2Ag^+ → Fe^{2+} + 2AgFe+2Ag+→Fe2++2Ag
等 Ag⁺ 基本反应完,铁才会去和 Cu²⁺ 反应。
四、一个生活类比
想象:
铁是一个人手里有钱(电子)
Ag⁺ 和 Cu²⁺ 是两个抢钱的人
谁更贪(更容易抢到钱)?
👉 Ag⁺ 抢得更快
等 Ag⁺ 抢完,Cu²⁺ 才能抢。
五、如果不是这样会发生什么?
假设:
铁一部分先和 Cu²⁺ 反应生成 Cu
生成的铜是活泼性比银强的金属:
Cu > Ag
那接下来:Cu+2Ag+→Cu2++2AgCu + 2Ag^+ → Cu^{2+} + 2AgCu+2Ag+→Cu2++2Ag
铜又会把银离子置换掉。
也就是说:
即使你"假设先反应 Cu²⁺",最终银离子还是会被消耗掉。
所以系统一定会演化成:
👉 银离子优先被全部反应
六、一个重要考试结论
在混合盐溶液中加入活泼金属:
一定先与最不活泼金属离子反应
口诀:
谁最不活泼,谁先被还原。
七、给你一个讲课总结板书
铁加入 Cu²⁺、Ag⁺ 混合溶液:
① Fe > Cu > Ag
② Ag⁺ 更易得电子
③ 电子优先给 Ag⁺
④ Ag⁺ 反应完后才反应 Cu²⁺
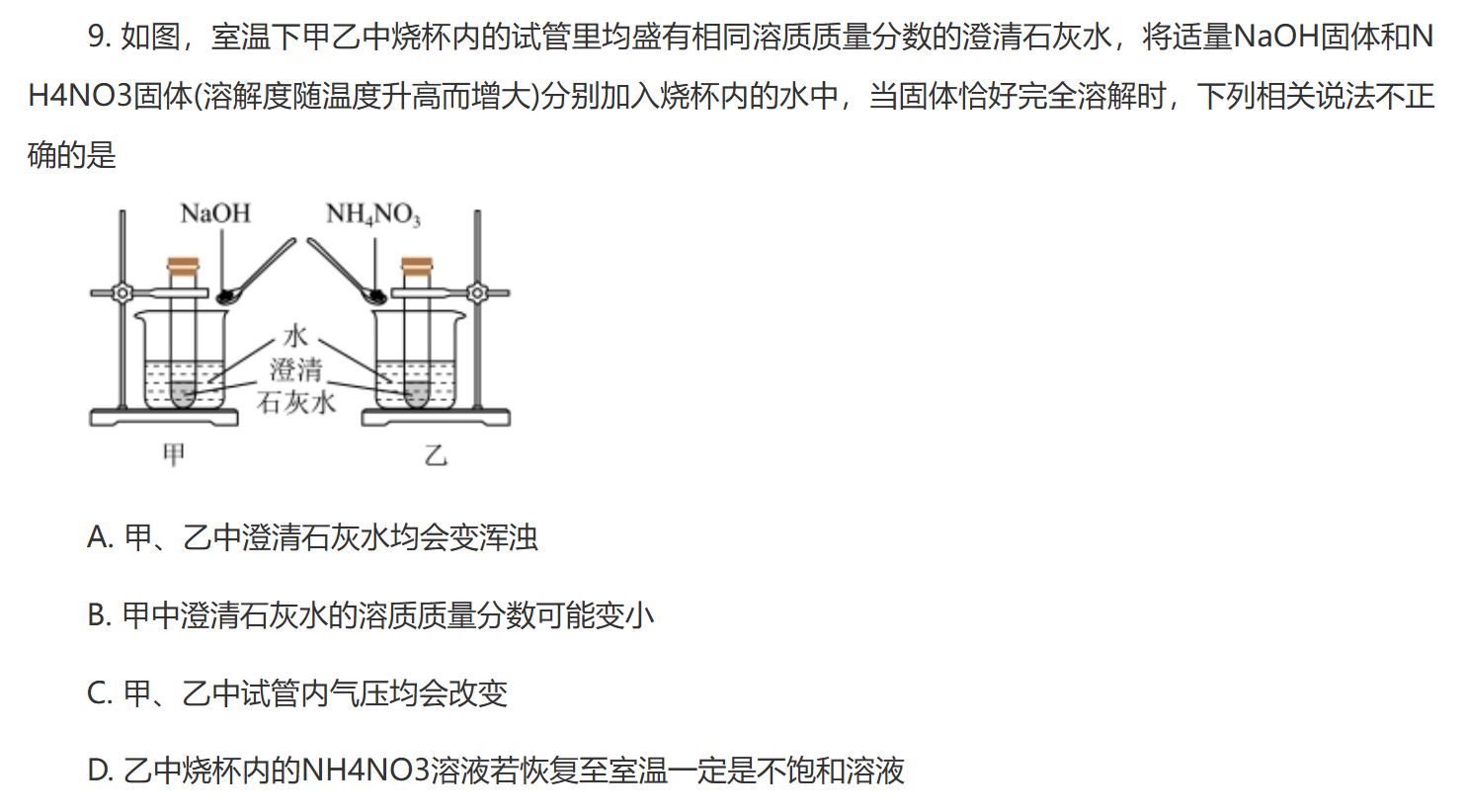
这道题是一个溶解热 + 石灰水性质 + 压强变化 + 溶解度受温度影响的综合题,我们逐项分析。
一、基础知识梳理
1️⃣ 澄清石灰水的本质
澄清石灰水是 Ca(OH)₂ 的饱和溶液。
特点:
- 微溶
- 溶解度随温度升高而减小
- 遇 CO₂ 变浑浊(生成 CaCO₃)
2️⃣ 两种物质溶解的热效应
| 物质 | 溶解热效应 |
|---|---|
| NaOH | 放热 |
| NH₄NO₃ | 吸热 |
二、逐项分析
🔹 A. 甲、乙中澄清石灰水均会变浑浊
甲(NaOH)
NaOH溶解放热 → 温度升高
Ca(OH)₂溶解度随温度升高而减小 → 析出 Ca(OH)₂ 固体
👉 变浑浊 ✔
乙(NH₄NO₃)
NH₄NO₃溶解吸热 → 温度降低
Ca(OH)₂溶解度随温度降低而增大
👉 原本饱和 → 变成不饱和
👉 不会析出沉淀
❌ 不会变浑浊
所以:
A 错误 ❌
🔹 B. 甲中澄清石灰水的溶质质量分数可能变小
甲中:
温度升高 → Ca(OH)₂析出
溶液中溶质减少
👉 溶质质量分数减小 ✔
B 正确 ✔
🔹 C. 甲、乙中试管内气压均会改变
温度变化 → 气体体积变化 → 气压变化
甲:
放热 → 升温 → 气压增大
乙:
吸热 → 降温 → 气压减小
✔ 两边都会变
C 正确 ✔
🔹 D. 乙中烧杯内 NH₄NO₃ 溶液若恢复至室温一定是不饱和溶液
题干说:
"当固体恰好完全溶解时"
这说明:
加入的量正好在当时温度下完全溶解
NH₄NO₃溶解吸热 → 温度降低 → 溶解度降低
当恢复室温时:
温度升高 → 溶解度变大
原来恰好完全溶解
恢复室温后溶解度更大
👉 一定是不饱和溶液 ✔
D 正确 ✔
三、最终答案
❌ 错误的是:
👉 A
四、考点总结
- 石灰水溶解度随温度升高而降低
- NaOH溶解放热
- NH₄NO₃溶解吸热
- 温度变化会影响气压
- 判断饱和溶液要结合"温度"