研究标题:结合亚区域放射组学与多通道二维或三维深度学习模型预测局部晚期食管鳞状细胞癌(LA-ESCC)患者对新辅助化疗免疫治疗(NACI)的反应

借鉴点:建模思路(看流程图理解就够了)
引言
食管癌是全球第七大常见恶性肿瘤和第六大癌症相关死亡原因,构成重大健康挑战。约一半病例在中国发现,主要为食管鳞状细胞癌(ESCC)。约一半病例在中国发现,主要为食管鳞状细胞癌。对于局部晚期食管鳞状细胞癌(LA-ESCC)患者,新辅助免疫治疗与化疗相结合显示出良好的治疗效果。然而,新辅助化疗免疫治疗(NACI)方案的益处仅限于部分患者。因此,迫切需要可靠的、非侵入性的生物标志物来预测治疗效果。影像组学是一种新兴的非侵入性技术,通过从医学图像中提取定量特征,为肿瘤生物学提供有价值的见解。而深度学习凭借强大的自动特征提取能力,能够从原始影像中挖掘复杂的空间关联并提取高维语义信息,对模型准确性和泛化能力的提升效果显著。因此,整合影像组学与深度学习构建疗效预测模型,有望为食管鳞状细胞癌患者提供更准确的新辅助化疗反应预测工具,推动精准医疗的进步。
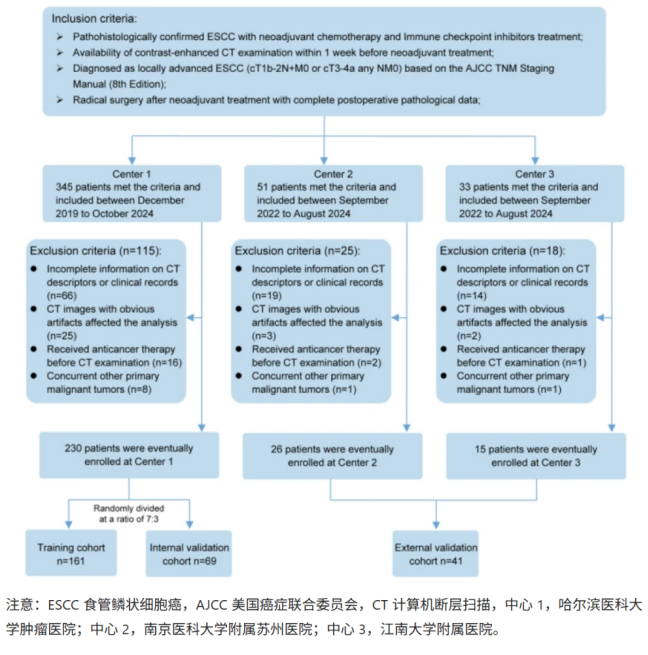
数据
该研究纳入三个医院的271名患者进行分析。其中,医院A的230例患者按照7:3比例随机划分为训练队列及内部验证队列,医院B和医院C的41例患者作为外部验证队列。
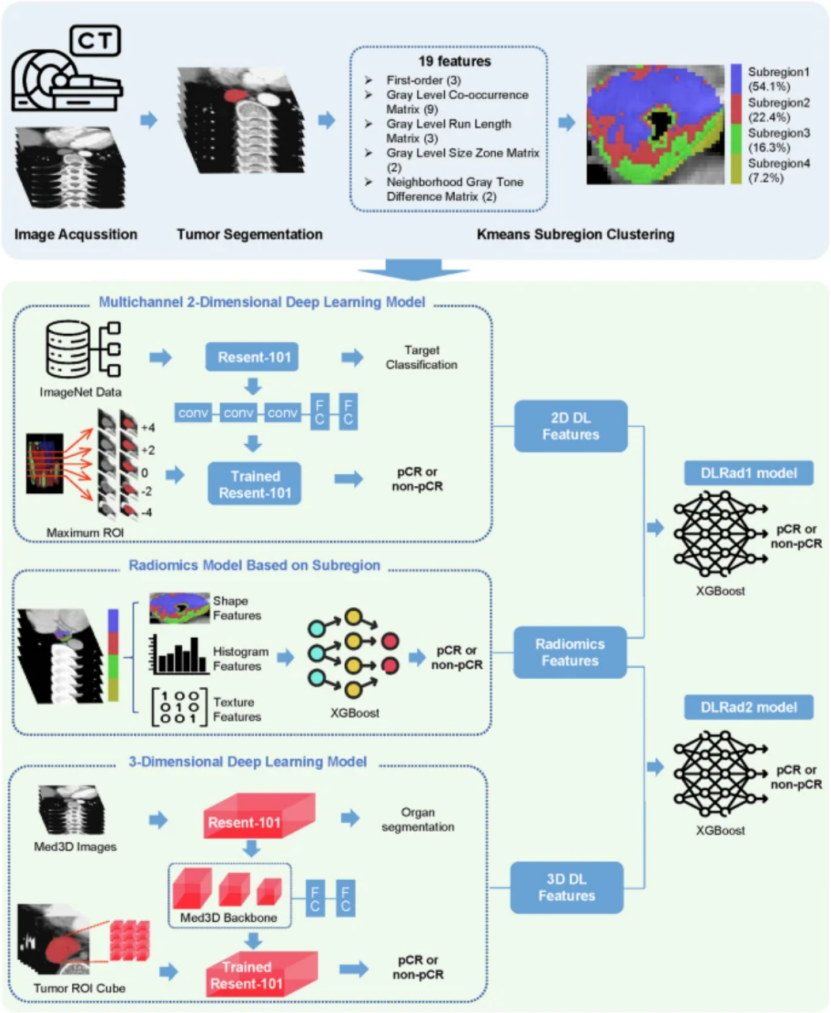
研究框架
Step1:生境区域划分
基于勾画的ROI区域,利用PyRadiomics从每个体素(1x1x1)中提取19个的放射组学特征。采用K-means聚类算法 对肿瘤区域进行子区域划分,具体而言,基于这些特征探索了 2 到 9 个聚类数量,Calinski--Harabasz 分数确定了最佳聚类数量,从而将肿瘤区域分割成多个亚区域。
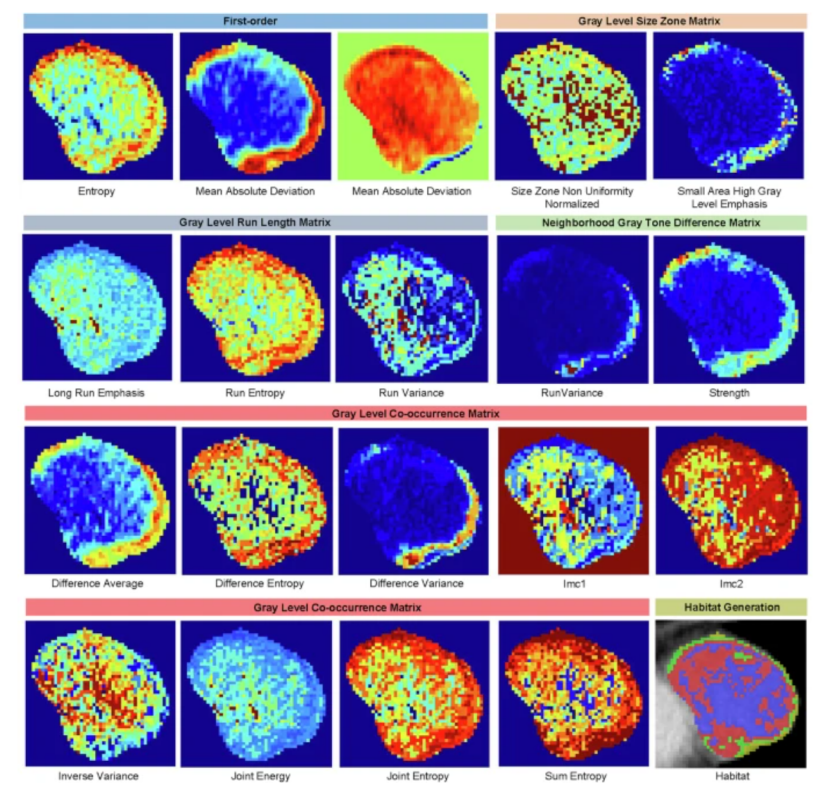 注:特征热图表示的是每个特征在每个体素上的值分布, 展示图应该为肿瘤最大截面
注:特征热图表示的是每个特征在每个体素上的值分布, 展示图应该为肿瘤最大截面
Step2: 特征提取
传统 影像组学 特征提取: 基于PyRadiomics,采用8种图像滤波器,对每个生境区域提取了1834项 特征。
2D DL特征提取 :利用预训练的ResNet101网络从多通道2D CT图像(包括肿瘤最大横截面及其上下五层切片,以捕捉肿瘤的空间上下文信息。)中提取2048个 多通道二维特征。(图像处理:线性插值将图像裁剪并调整大小为统一的 256 × 256 像素尺寸。采用随机水平翻转、随机垂直翻转以及裁剪至 224 × 224 像素等数据增强方法来扩充数据集并增强模型鲁棒性。最终输入图像尺寸标准化为 224 × 224 像素。)
3D DL特征提取 :使用预训练的3D ResNet101框架从肿瘤的3D立方体区域中提取2048个三维 深度学习特征,以提取肿瘤的立体结构信息。(图像处理:ROI 立方体被线性插值到 96×96×96 体素的大小)
Step3:特征选择
Z 分数标准化对所有特征进行标准化处理, Spearman相关性分析去除相关系数≥0.9的特征,组内相关系数(ICC)过滤去除冗余和不稳定特征(观察者内和观察者间 ICC<=0.75),Lasso分析选择出对pCR预测最具信息量的关键特征。
Step4: 模型构建
将亚区域1放射组学特征与深度学习特征进行融合形成联合特征向量,使用 XGBoost 算法分别构建基于特征的融合模型。两种融合模型如下:DLRad1,结合了基于亚区域1的影像组学特征和多通道 2D 深度学习特征;DLRad2,结合了亚区域1的影像组学特征与 3D 深度学习特征。
研究结局
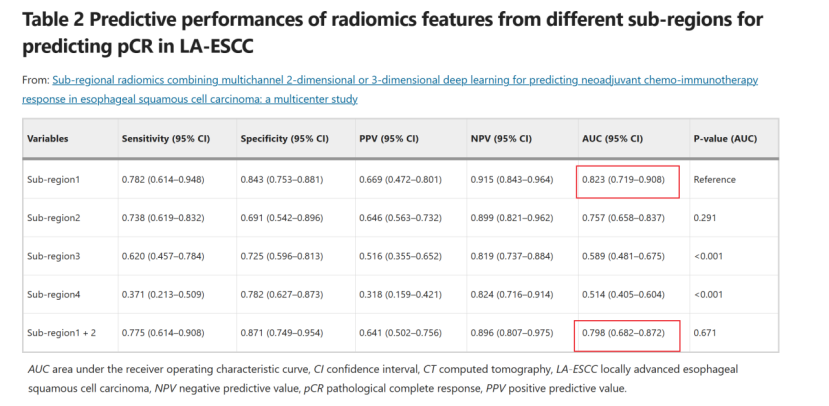
生境区域划分及代表性生境区域选择
对于19个像素级特征,采用kmeans聚类进行亚区域划分。Calinski-Harabasz指数确定最佳聚类数为4,表明肿瘤区域被分割成四个亚区域。且亚区域2、3、4的预测性能显著低于亚区域1,亚区域1与亚区域2的组合并未提高诊断性能(P = 0.671)。因此,下续分析中仅将亚区域1的传统放射组学特征与深度学习特征进行联合建模。
特征选择与模型构建
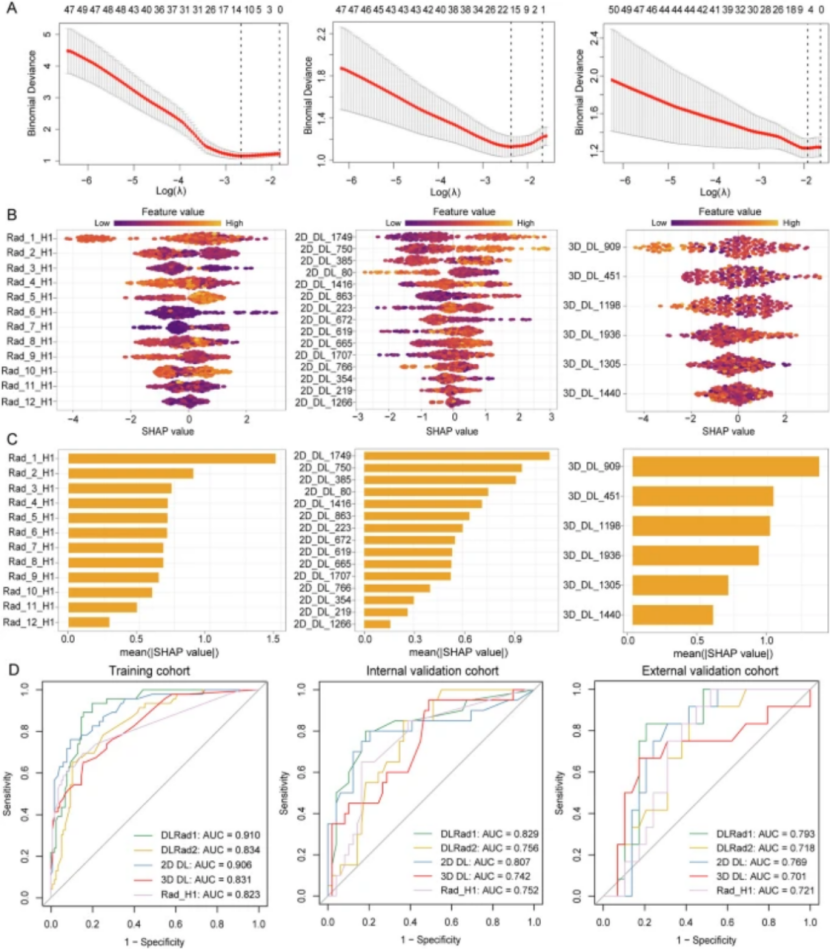
经过Spearman相关性和ICC过滤后,lasso进行最终特征选择。最终,亚区域1放射组学特征选择了12个关键特征,2D DL特征保留了15个关键特征,3D DL特征保留了6个关键特征。
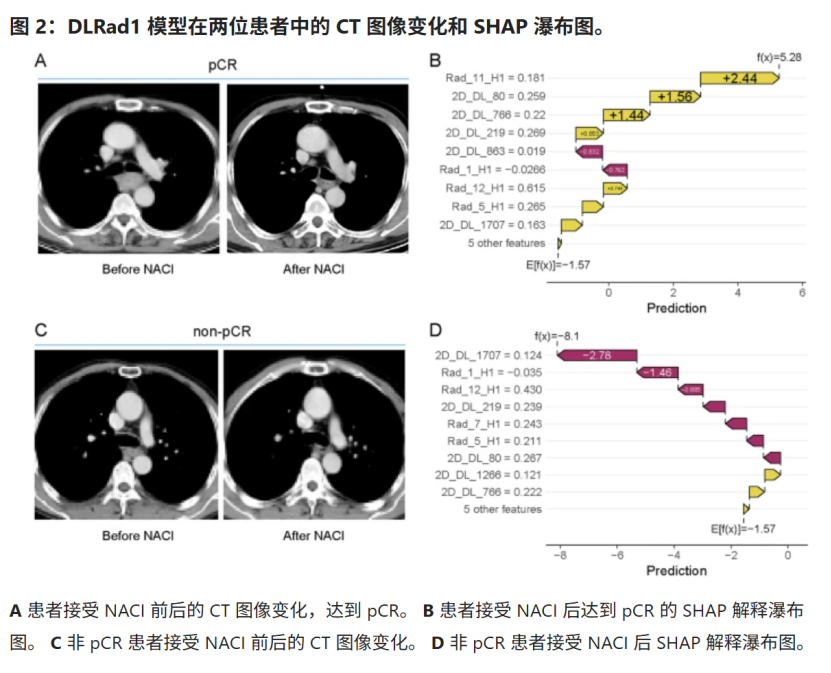
分别基于亚区域1放射组学特征+2D DL特征、放射组学+3D DL进行建模。DLRad1模型 的 AUC(训练集0.910,内部验证集0.829,外部验证集0.793)高于DLRad 2, 校准曲线 在不同概率区间表现出强一致性,且具有更高的净收益。SHAP 瀑布图进一步可视化了单个特征在预测 pCR和非 pCR中的贡献(图2)。
临床模型开发与模型比较
为探究影像组学特征是否能在常规临床参数之外提升预测性能,单变量和多变量逻辑回归分析用于识别与病理完全缓解(pCR)独立相关的临床因素。肿瘤长度成为唯一的显著临床预测因子(优势比[OR] = 0.549,95%置信区间[CI]:0.180--0.915,P = 0.045)。随后,本研究开发了一个结合临床模型和 DLRad1 特征的组合模型,以评估影像组学特征的附加预测价值。训练队列中,联合模型达到了最高的 AUC(0.919,95% CI:0.885--0.962),优于临床模型(AUC=0.617,95% CI:0.536--0.698)和 DLRad1 模型(AUC=0.910,95% CI:0.867--0.954)。IDI 和 NRI 分析均显示,在临床模型中添加 DLRad1 时,判别力和分类能力均有统计学显著提升(IDI=0.095 [0.038--0.151],P<0.001;NRI=0.317 [0.156--0.472],P<0.001)。
参考文献:ZHU J, XU B, FAN T, 等. Sub-regional radiomics combining multichannel 2-dimensional or 3-dimensional deep learning for predicting neoadjuvant chemo-immunotherapy response in esophageal squamous cell carcinoma: a multicenter study[J/OL]. npj Precision Oncology, 2025, 9(1)[2025-07-26].