Expanding the plant epigenetic code: histone short-chain acylation
拓展植物表观遗传密码:组蛋白短链酰化修饰

研究亮点
植物基因表达受到表观遗传调控,而组蛋白短链酰化修饰在这一精密调控网络中发挥关键作用。植物中的组蛋白酰化修饰可介导代谢与基因表达的关联 ------ 巴豆酰辅酶 A、琥珀酰辅酶 A、乳酰辅酶 A 等酰基供体均来源于 β- 氧化、三羧酸循环(TCA 循环)及糖酵解等代谢通路,可作为代谢状态的感知信号。植物组蛋白存在多个短链酰化修饰位点,通过质谱技术对这些位点进行系统性鉴定分析,可为后续酰化修饰的功能研究提供关键依据。表观遗传调控因子可同时调控组蛋白与非组蛋白的酰化修饰,进而协同调控植物生长发育及逆境适应性。
摘要
植物基因表达调控依赖复杂的表观遗传机制。在传统研究中,组蛋白乙酰化与甲基化修饰一直被视为调控染色质动态变化及转录过程的核心因素。然而,近年来的研究发现,巴豆酰化、丁酰化、β- 羟基丁酰化、2 - 羟基异丁酰化、琥珀酰化及乳酰化等新型赖氨酸短链酰化修饰,正逐渐成为表观遗传调控领域的新兴研究方向。尽管这类修饰在哺乳动物中的特征已得到充分阐释,但越来越多的证据表明其在植物中同样广泛存在。本研究聚焦植物组蛋白酰化修饰的特有研究成果,系统分析其代谢来源、催化酶(writer)、去修饰酶(eraser),及其在植物生长发育与逆境适应过程中的生物学功能。对高等植物中这类修饰的深入研究,有望揭示调控植物发育可塑性与环境适应性的独特分子机制,进而为作物遗传改良及可持续农业发展开辟新路径。
植物中组蛋白赖氨酸酰化修饰的鉴定
表观遗传修饰(详见术语表)在介导环境信号与植物基因组调控的关联中发挥关键作用。长期以来,组蛋白甲基化、乙酰化等组蛋白修饰,一直被认为是调控染色质结构及转录活性的重要方式(见专栏 1)。近年来,组蛋白赖氨酸残基上发现的多种短链酰化修饰类型 ------ 包括乙酰化(Kac)、巴豆酰化(Kcr)、丁酰化(Kbu)、β- 羟基丁酰化(Kbhb)、2 - 羟基异丁酰化(Khib)、琥珀酰化(Ksu)及乳酰化(Kla),极大地拓展了表观遗传调控的研究范畴 [1., 2., 3., 4., 5., 6., 7.]。这些新型组蛋白酰化修饰的发现,揭示了表观遗传调控的复杂性,也为基因表达与染色质动态调控机制增添了新的研究维度。
专栏 1 组蛋白乙酰化与酰化修饰调控基因表达的机制
核小体是染色质的基本结构单元,由 DNA 缠绕组蛋白八聚体构成,该八聚体包含各两分子的组蛋白 H2A、H2B、H3 与 H4 [86]。核心组蛋白上的多个氨基酸残基可发生多种翻译后修饰(PTM),其中就包括乙酰化以及巴豆酰化、丁酰化、2 - 羟基异丁酰化、琥珀酰化、乳酰化等短链酰化修饰,这些修饰通过不同机制调控染色质的结构与功能 [87]。以赖氨酸乙酰化为例,其调控染色质结构进而影响转录过程的机制主要体现在以下方面:带正电的赖氨酸残基本可与带负电的 DNA 骨架形成盐桥;而乙酰化修饰不仅会引入空间位阻更大的乙酰基团,还会中和赖氨酸的正电荷,从而显著降低组蛋白与 DNA 的结合亲和力,提高染色质的可及性,以利于转录因子的结合 [86]。同理,其他类型的酰化修饰也可通过电荷中和作用减弱组蛋白与 DNA 的相互作用 [88]。值得注意的是,不同酰化修饰因其独特的理化性质,可能具备特定的调控功能。
尽管早期针对这类新型酰化修饰的研究主要集中于动物细胞 [1,6,8,9],但随着高分辨率质谱技术的发展,这类修饰已在植物中被成功鉴定。这表明,这类能够调控蛋白质功能与互作的翻译后修饰(PTM)在演化上具有保守性。近期研究证实,翻译后修饰在调控植物生长发育及逆境响应过程中发挥着重要作用 [10., 11., 12., 13., 14., 15.]。本文综述了植物中组蛋白酰化修饰的研究进展,并简要阐述了近年来植物研究领域备受关注的非组蛋白酰化修饰。文中总结了当前关于酰化修饰功能的研究证据,同时展望了这一快速发展领域面临的挑战与未来方向。
化学多样性:赖氨酸酰化修饰的结构与特性
与乙酰化不同,赖氨酸酰化修饰所连接的酰基在链长、分子体积及化学性质上均存在差异,进而通过不同方式影响核小体的动态变化 [16., 17., 18.]。例如,虽然乙酰化(Kac)与巴豆酰化(Kcr)均可中和赖氨酸的正电荷,但巴豆酰化会引入平面结构,进而对核小体稳定性及转录调控产生额外的调控作用 [16., 17., 18.]。同理,2 - 羟基异丁酰化(Khib)与琥珀酰化(Ksu)会引入分子体积更大、亲水性更强的基团,可能通过独特的方式改变组蛋白与 DNA 的相互作用 [6]。总体而言,每种酰化修饰都会为赖氨酸残基赋予特定的化学基团,并对组蛋白结构及基因调控功能产生差异化影响。下文将总结这些不同类型酰化修饰的结构特征。
丁酰化(Kbu)与巴豆酰化(Kcr)
丁酰化(Kbu)与巴豆酰化(Kcr)分别是在赖氨酸残基上引入丁酰基与巴豆酰基的修饰类型。两种修饰均会引入疏水性更强的延伸烃链,增大赖氨酸残基的空间位阻(见图 1),从而影响核小体的组装状态与染色质的可及性 [6]。值得注意的是,巴豆酰基含有碳 - 碳双键,这一结构使其具有刚性的平面构型,也是其区别于其他组蛋白酰化修饰的重要特征(见图 1)[1,19]。
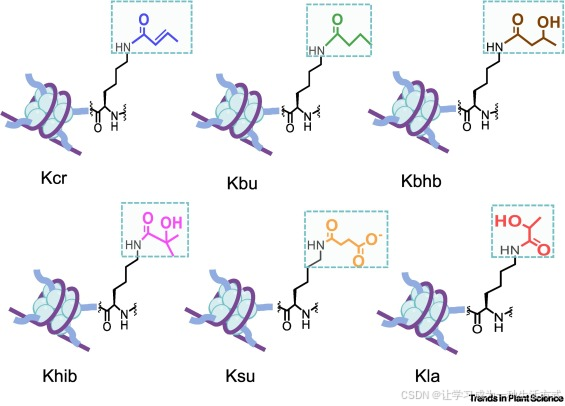
图 1 不同类型组蛋白赖氨酸酰化修饰的化学结构
不同短链酰基以不同颜色标注。缩略词说明:Kbhb,赖氨酸 β- 羟基丁酰化;Kbu,丁酰化;Kcr,巴豆酰化;Khib,2 - 羟基异丁酰化;Kla,乳酰化;Ksu,琥珀酰化。
β- 羟基丁酰化(Kbhb)与 2 - 羟基异丁酰化(Khib)
这两类修饰的特征是在赖氨酸残基上分别引入 β- 羟基丁酰基与 2 - 羟基异丁酰基这两种羟基化酰基。羟基的存在不仅增加了组蛋白尾部的极性,同时也增大了其空间位阻(见图 1),进而影响核小体稳定性、组蛋白 - DNA 互作及转录调控因子的招募 [3,20,21]。此外,这两种修饰的水平与 β- 羟基丁酸和 2 - 羟基异丁酸的代谢波动密切相关,因此它们不仅能改变局部染色质结构,还可作为代谢信号指示器,介导细胞能量状态与表观遗传调控的关联 [3,20,21]。
琥珀酰化(Ksu)
该修饰的特征是在赖氨酸残基上引入一个四碳琥珀酰基(见图 1)。相较于乙酰基,琥珀酰基分子体积更大且酸性更强;这一带有负电荷的基团不仅会中和赖氨酸残基的正电荷,甚至可使其电荷性质发生反转,从而显著改变组蛋白尾部的静电分布特征 [6,22]。这种电荷转变可能引发核小体构象的剧烈变化,影响染色质的压缩状态,最终调控转录可及性与基因表达水平 [23]。
乳酰化(Kla)
乳酰化是近年新发现的一种组蛋白修饰,其机制是源自乳酸的三碳极性乳酰基与赖氨酸残基发生共价结合(见图 1)[24]。该修饰最初在动物细胞中被鉴定 [24],可改变赖氨酸侧链的极性与分子体积,进而潜在影响染色质重塑因子、转录因子及组蛋白修饰酶的招募,最终促进染色质重塑并调控基因表达 [25]。
质谱分析结果显示,在多种植物中已鉴定出近 200 个组蛋白赖氨酸短链酰化修饰位点(见图 2)[10., 11., 12., 13., 14., 15.,26., 27., 28., 29., 30., 31., 32., 33., 34., 35., 36., 37., 38., 39., 40.]。研究对象既包括拟南芥(54 个位点)、水稻(90 个位点)等模式植物,也涵盖玉米(57 个位点)、棉花(16 个位点)、小麦(95 个位点)等大宗作物,以及番茄(2 个位点)等园艺作物(见图 2)[10., 11., 12., 13., 14., 15.,26., 27., 28., 29., 30., 31., 32., 33., 34., 35., 36., 37., 38., 39., 40.]。
已鉴定的修饰类型包括巴豆酰化(8 个位点)、丁酰化(2 个位点)、乳酰化(4 个位点)、琥珀酰化(3 个位点)及 2 - 羟基异丁酰化(9 个位点),这些修饰位点主要分布于组蛋白 H3 与 H4 的 N 端尾部区域(见图 2)。值得注意的是,在组蛋白的球形结构域中也检测到了酰化修饰信号(见图 2),这一分布模式与动物细胞中的观测结果一致,凸显了酰化修饰图谱在演化上的保守性 [6,17]。
此外,在 4 种及以上植物中,组蛋白 H3 赖氨酸 23 位(H3K23)、H3K56、H3K79、H4K8、H4K31、H4K79 及 H4K91 等位点可发生至少 3 种不同类型的酰化修饰(见图 2)。这一现象表明,这些位点是表观遗传调控中保守的修饰热点区域(见图 2)。
尽管目前对组蛋白的研究主要集中于 H3 与 H4(与动物中的研究趋势一致),但质谱分析也已在植物的组蛋白 H2A 与 H2B 上鉴定出多个重要的酰化修饰位点 [6,17](见图 2)。然而,H2A/H2B 酰化修饰在真核生物中的功能意义尚未被深入探究,这也是当前染色质动态调控机制研究中亟待填补的关键空白。
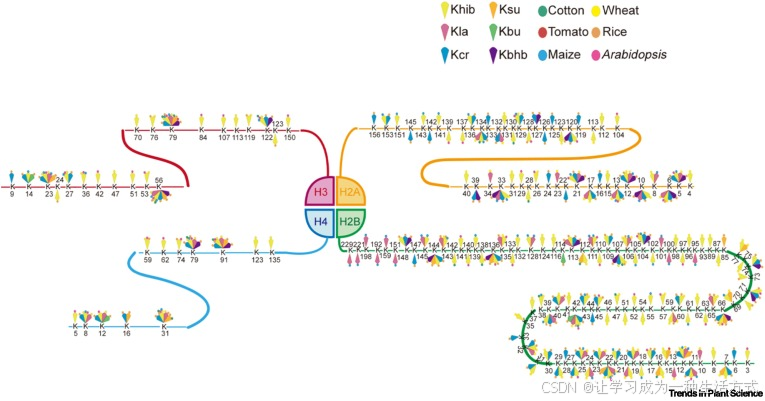
图 2 代表性植物物种组蛋白赖氨酸酰化修饰的分布特征
彩色扇形代表不同类型的赖氨酸短链酰化修饰,彩色圆点代表不同植物物种。缩略词说明:Kbhb,赖氨酸 β- 羟基丁酰化;Kbu,丁酰化;Kcr,巴豆酰化;Khib,2 - 羟基异丁酰化;Kla,乳酰化;Ksu,琥珀酰化。
植物中酰基辅酶 A 供体的代谢来源
组蛋白酰化修饰并非是乙酰化修饰的简单结构变体,其还与细胞代谢活动密切相关 ------每种酰化修饰均来源于特定的代谢通路。在动物细胞中,这类修饰的酰基供体为不同的辅酶 A(CoA)偶联型酰基分子,而这些分子同时也是代谢网络中的关键中间产物。尽管动物细胞中组蛋白酰化修饰的代谢来源已阐释明确,但植物细胞中多数非乙酰化酰化修饰的具体来源,目前仍处于深入研究阶段。不过已有研究证据显示,与动物类似,植物或许也能利用不同的代谢库,为组蛋白酰化修饰提供酰基辅酶 A。
巴豆酰化(Kcr)与丁酰化(Kbu)
在动物细胞中,巴豆酰辅酶 A 与丁酰辅酶 A 分别是 Kcr 与 Kbu 修饰的直接底物,二者主要来源于脂肪酸 β- 氧化途径产生的短链脂肪酸 [41,42]。其中,丁酰辅酶 A 经由 β- 氧化通路生成 [41,42](见图 3);在脂肪酸氧化过程中,支链 α- 酮酸脱氢酶复合体(BCDH)、短链酰基辅酶 A 脱氢酶(ACADS)及酰基辅酶 A 氧化酶 3(ACOX3)可催化丁酰辅酶 A 转化为巴豆酰辅酶 A [41,42](见图 3)。此外,在赖氨酸与色氨酸的分解代谢过程中,戊二酰辅酶 A 脱氢酶(GCDH)可通过催化戊二酰辅酶 A 的氧化脱羧反应,参与巴豆酰辅酶 A 的生物合成 [43,44](见图 3)。
在植物体内,过氧化物酶体中的 β- 氧化途径是脂肪酸降解的主要通路,同时植物基因组中也存在编码酰基辅酶 A 生成相关酶类的同源基因。这表明,Kcr 与 Kbu 修饰的酰基供体或许也来源于该途径(见图 3)。
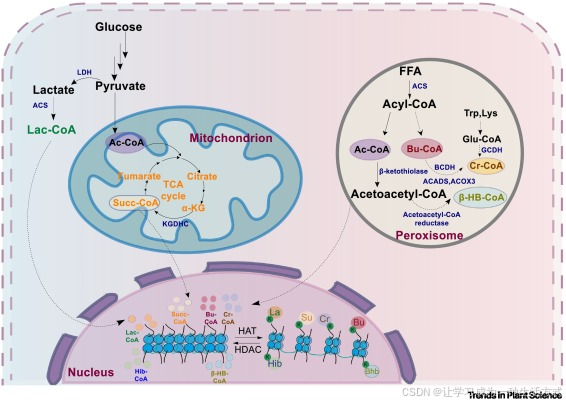
图 3 植物细胞中酰基辅酶 A 的代谢通路
在细胞质基质中,糖酵解途径产生的丙酮酸可在 L - 乳酸脱氢酶的催化下转化为乳酸,乳酸随后进一步代谢生成乳酰辅酶 A(Lac-CoA)。同时,丙酮酸可被转运至线粒体中,经氧化脱羧反应生成乙酰辅酶 A(Ac-CoA)。线粒体中的乙酰辅酶 A 既是三羧酸循环(TCA 循环)的底物,也可在 α- 酮戊二酸脱氢酶复合体(KGDHC)的作用下生成琥珀酰辅酶 A(Succ-CoA)。此外,过氧化物酶体中的脂肪酸 β- 氧化途径一方面会生成乙酰乙酰辅酶 A,后者经乙酰乙酰辅酶 A 还原酶催化还原为 β- 羟基丁酰辅酶 A(β-HB-CoA);另一方面,该途径也可能是丁酰辅酶 A(Bu-CoA)的来源之一,丁酰辅酶 A 可进一步转化为巴豆酰辅酶 A(Cr-CoA)。值得注意的是,赖氨酸与色氨酸的分解代谢过程同样可能产生巴豆酰辅酶 A。缩略词说明:ACADS,短链酰基辅酶 A 脱氢酶;ACOX3,酰基辅酶 A 氧化酶 3;ACS,酰基辅酶 A 合成酶;BCDH,支链 α- 酮酸脱氢酶复合体;Bhb,β- 羟基丁酰化;Bu,丁酰化;Cr,巴豆酰化;FFA,游离脂肪酸;GCDH,戊二酰辅酶 A 脱氢酶;HAT,组蛋白乙酰转移酶;HDAC,组蛋白去乙酰化酶;Hib,2 - 羟基异丁酰化;KDHC,α- 酮戊二酸脱氢酶复合体;α-KG,α- 酮戊二酸;KGDHC,α- 酮戊二酸脱氢酶复合体;La,乳酰化;LDH,乳酸脱氢酶;Su,琥珀酰化;TCA,三羧酸循环。
β- 羟基丁酰化(Kbhb)
在动物细胞中,β- 羟基丁酰化是一种受代谢物诱导的组蛋白修饰,与酮体代谢密切相关。该修饰在营养胁迫条件下(尤其是碳水化合物缺乏或饥饿状态时)可作为表观遗传调控因子发挥作用 ------ 此时 β- 羟基丁酸会大量积累,成为细胞的替代能量底物 [45]。在这一代谢背景下,β- 羟基丁酸可在酰基辅酶 A 合成酶(ACSS)的催化下转化为 β- 羟基丁酰辅酶 A,进而为 β- 羟基丁酰化修饰提供直接前体物质 [45]。有趣的是,植物体内似乎存在一条独特的生物合成通路:首先在 β- 酮硫解酶的作用下,乙酰辅酶 A 转化为乙酰乙酰辅酶 A;随后乙酰乙酰辅酶 A 经乙酰乙酰辅酶 A 还原酶介导还原,生成 β- 羟基丁酰辅酶 A [46]。值得关注的是,我们团队近期的研究通过实验证实,植物体内同样存在酮体物质 β- 羟基丁酸 [47],这表明植物可能同时利用从头合成途径与依赖 β- 羟基丁酸的合成途径,完成 β- 羟基丁酰辅酶 A 的生物合成。
2 - 羟基异丁酰化(Khib)
2 - 羟基异丁酰化的直接底物为 2 - 羟基异丁酰辅酶 A,该物质由 2 - 羟基异丁酸合成而来。2 - 羟基异丁酸是一种短链脂肪酸,广泛存在于人体血液、尿液、粪便等多种生物体液中 [4,48]。但目前,植物体内合成 2 - 羟基异丁酸及 2 - 羟基异丁酰辅酶 A 的代谢通路仍尚不明确。不过,我们前期的研究已在植物组织中检测到 2 - 羟基异丁酰辅酶 A 及其前体物质 2 - 羟基异丁酸的存在 [15]。未来仍需开展进一步研究,以阐明植物中介导 2 - 羟基异丁酰化修饰的代谢通路。
琥珀酰化(Ksu)
琥珀酰化修饰来源于琥珀酰辅酶 A,后者是三羧酸循环中的关键中间产物。在植物体内,三羧酸循环发生于线粒体中,该过程可产生琥珀酰辅酶 A(见图 3),而琥珀酰辅酶 A 既是能量生成过程的核心代谢物,也是生物合成的重要原料。
乳酰化(Kla)
在动物细胞中,乳酰化修饰与乳酸代谢密切相关 ------ 乳酸是无氧糖酵解途径的副产物 [49]。在哺乳动物体内,乙酰辅酶 A 合成酶 2(ACSS2)可发挥乳酰辅酶 A 合成酶的功能,直接催化乳酸转化为乳酰辅酶 A [50]。在植物体内,细胞质中的 NAD 依赖型乳酸脱氢酶可催化丙酮酸生成乳酸,同时植物基因组中也已鉴定出 ACSS2 的同源基因,这表明植物中可能存在保守的乳酰辅酶 A 合成通路(见图 3)。值得注意的是,已有研究发现,植物在低氧和干旱胁迫条件下,体内乳酸水平会发生动态变化 [29,52]。但目前,关于植物乳酸代谢与组蛋白乳酰化修饰存在直接关联的证据,仍有待进一步挖掘。
植物蛋白质赖氨酸酰化修饰的催化酶与去修饰酶
鉴定组蛋白酰化修饰的催化酶(writer)与去修饰酶(eraser)(见专栏 2),是揭示这类修饰在植物表观遗传调控中功能潜力的关键。尽管组蛋白酰化修饰的重要性正逐渐得到认可,但目前对植物中调控这类修饰的酶学机制,仍缺乏充分的解析。
专栏 2 组蛋白赖氨酸酰化修饰的催化酶与去修饰酶
催化酶(writer)是一类能够催化酰基基团连接至组蛋白赖氨酸残基 ε- 氨基位点的酶类 [6,89]。这类酶通常为组蛋白乙酰转移酶(HAT),可催化产生包括乙酰化在内的多种酰化修饰,通过影响染色质结构调控基因表达,在植物生长发育及逆境响应过程中发挥关键作用。与之相对,去修饰酶(eraser)的功能是移除这些酰化修饰,从而重置或精细调控染色质状态 [6,89]。去修饰酶多属于组蛋白去乙酰化酶(HDAC)家族,其中包括依赖 NAD⁺的沉默信息调节因子(sirtuin)蛋白。催化酶与去修饰酶之间的动态互作,赋予了植物表观遗传调控的灵活性,这一特性对于植物适应环境变化和精准调控基因表达至关重要。
在真核生物中,组蛋白乙酰转移酶(HAT)与组蛋白去乙酰化酶(HDAC)构成了两个庞大的酶家族,分别负责催化赖氨酸乙酰化的添加与移除。近期研究表明,在动物细胞中,这些酶的催化活性并不局限于乙酰化修饰。例如,哺乳动物中的组蛋白乙酰转移酶 p300 除了催化经典的赖氨酸乙酰化(Kac)外,还可介导巴豆酰化(Kcr)、丁酰化(Kbu)、2 - 羟基异丁酰化(Khib)、乳酰化(Kla)等多种酰化修饰 [4,24,53,54](见图 4A)。此外,Ⅰ 类和 Ⅱ 类组蛋白去乙酰化酶,以及沉默信息调节因子(sirtuin)家族去乙酰化酶,均表现出广泛的底物特异性,能够移除乳酰化、琥珀酰化、巴豆酰化等多种酰基修饰 [55,56,57,58](见图 4A)。这些研究表明,不同类型酰化修饰的酶学调控机制存在显著的功能重叠,部分酶类可作用于多种酰化修饰位点。
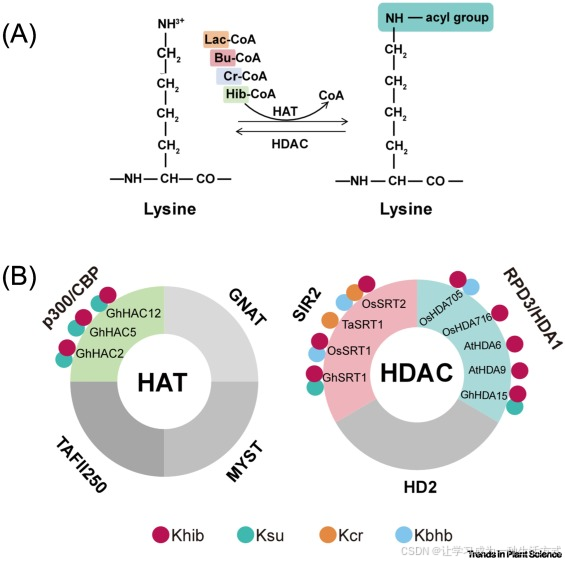
图 4 赖氨酸酰化修饰的催化酶与去修饰酶
(A)组蛋白乙酰转移酶(HAT)与组蛋白去乙酰化酶(HDAC)对赖氨酸残基酰基的添加与移除作用。(B)赖氨酸酰基转移酶(催化酶)与去酰化酶(去修饰酶)的酶学活性。缩略词说明:At,拟南芥;Bu-CoA,丁酰辅酶 A;CBP,环磷腺苷效应元件结合蛋白结合蛋白;Cr-CoA,巴豆酰辅酶 A;Gh,陆地棉;GNATs,GCN5 相关 N - 乙酰转移酶家族;HAT,组蛋白乙酰转移酶;HDAC,组蛋白去乙酰化酶;Hib-CoA,2 - 羟基异丁酰辅酶 A;Kbhb,赖氨酸 β- 羟基丁酰化;Kcr,巴豆酰化;Khib,2 - 羟基异丁酰化;Ksu,琥珀酰化;Lac-CoA,乳酰辅酶 A;MYST,Moz、Ybf2、Sas2 及 Tip60 蛋白家族;Os,水稻;RPD3,钾离子依赖降低蛋白 3;SIR2,沉默信息调节因子 2;Ta,小麦;TAFII250,TATA 结合蛋白相关因子 Ⅱ250。
在植物中,酰化修饰催化酶与去修饰酶的鉴定及功能解析仍较为有限。迄今为止,大多数研究的核心仍聚焦于鉴定酰化修饰类型,而非解析调控这些修饰的酶类。植物组蛋白乙酰转移酶(HAT)主要分为四大家族:GNAT 家族(Gcn5 相关 N - 乙酰转移酶)、MYST 家族(Moz、Ybf2、Sas2 及 Tip60 蛋白家族)、p300/CBP 家族(p300 / 环磷腺苷效应元件结合蛋白结合蛋白)以及 TAFII250 家族(TATA 结合蛋白相关因子 Ⅱ250)。其中,p300/CBP 家族因与哺乳动物 p300 蛋白具有同源性,在酰化修饰研究中备受关注 [59]。在陆地棉中,该家族成员 GhHAC2、GhHAC5 及 GhHAC12 是目前植物中已报道的唯一一类酰化修饰催化酶,能够催化非组蛋白的 2 - 羟基异丁酰化(Khib)与琥珀酰化(Ksu)修饰 [14](见图 4B)。不过,植物组蛋白乙酰转移酶针对组蛋白的特异性酰基转移酶活性尚未得到验证。基于其与哺乳动物组蛋白乙酰转移酶的同源性,有假说认为植物组蛋白乙酰转移酶可能对组蛋白具有广泛的酰基转移酶活性,但这一功能仍需在植物体内开展进一步的实验验证。
在去修饰酶方面,植物组蛋白去乙酰化酶(HDAC)分为三大家族:RPD3/HDA1 家族(钾离子依赖降低蛋白 3 / 组蛋白去乙酰化酶 1)、沉默信息调节因子家族(SRTs)以及植物特有的 HD2 家族(组蛋白去乙酰化酶 2)。与动物中的研究结果类似,植物中的多数研究表明,组蛋白去乙酰化酶同样具备去酰化酶活性。例如,水稻中的 OsSRT2 是植物中首个被报道的组蛋白去巴豆酰化酶,通过对ossrt2突变体的免疫印迹分析及体外酶活实验证实,该蛋白可调控体内巴豆酰化(Kcr)修饰水平 [10](见图 4B)。无独有偶,小麦中的 TaSRT1 同样具有组蛋白去巴豆酰化酶活性,可通过调控磷酸甘油酸激酶(PGK)的巴豆酰化水平,影响该蛋白的稳定性 [60](见图 4B)。在缺失OsHDA705、OsHDA716、OsSRT1及OsSRT2基因的水稻突变体中,2 - 羟基异丁酰化(Khib)修饰水平显著升高,结合体外实验证据表明,这些基因编码的酶均具有 2 - 羟基异丁酰化去修饰酶活性 [35](见图 4B)。进一步研究发现,OsHDA705 可调控组蛋白的 2 - 羟基异丁酰化修饰 [15,35],而拟南芥中的同源蛋白 AtHDA6 与 AtHDA9 也具有类似功能 [26](见图 4B)。此外,OsHDA705、OsSRT1 及 OsSRT2 还被证实对组蛋白的 β- 羟基丁酰化(Kbhb)具有去酰化酶活性 [47](见图 4B)。在陆地棉中,GhHDA15 与 GhSRT1 可靶向作用于组蛋白的 2 - 羟基异丁酰化与琥珀酰化修饰,发挥去酰化酶功能 [14](见图 4B)。相比之下,HD2 家族在组蛋白去酰化修饰中的作用尚不明确。鉴于该家族是植物特有的酶类家族,对其催化活性开展深入研究,有望挖掘出植物表观遗传调控中全新的分子机制。
综上,尽管动物中组蛋白酰化修饰的关键调控酶已被充分解析,但植物领域的相关研究仍处于起步阶段。未来研究应优先对这些酶类开展全面的功能鉴定,尤其是明确其对酰基底物的特异性,从而深入阐明赖氨酸短链酰化修饰在植物生长发育及环境适应性调控中的分子机制。
生物学功能:赖氨酸酰化修饰介导植物发育与逆境响应的关联
赖氨酸酰化修饰在植物发育调控中发挥关键作用
哺乳动物中的研究证实,巴豆酰化(Kcr)、丁酰化(Kbu)、乳酰化(Kla)等不同类型的组蛋白酰化修饰,在胚胎发生、干细胞分化、组织成熟等关键发育转变期会发生动态变化 [1,61,62,63]。例如,在减数分裂后的雄性生殖细胞中,组蛋白巴豆酰化修饰在性染色体上高度富集,可标记睾丸特异性基因的活性启动子区域,进而促进这些基因的转录,为精子发生过程提供支持 [1]。同样,组蛋白 H4K5 位点的丁酰化修饰可维持基因的激活状态,并抑制溴结构域蛋白的结合,从而调控精子发育过程中的基因组结构 [62]。组蛋白乳酰化修饰则在卵母细胞成熟及早期胚胎发育中发挥调控作用,其修饰水平升高可通过改变氧化磷酸化(OXPHOS)与糖酵解相关基因的转录,影响上述发育进程 [63]。总体而言,这些酰化修饰可作为响应性表观遗传标记,介导细胞代谢状态与发育关键基因调控网络的关联。
相较于动物研究,目前对植物发育过程中酰化修饰的认知仍较为有限,但近年来的研究进展已开始揭示其调控潜力。长期以来,组蛋白乙酰化(Kac)被认为是调控种子萌发、营养生长及开花等过程中基因表达的关键因素 [64]。近期植物蛋白质组学研究发现,赖氨酸酰化修饰在植物不同组织中呈现出多样化的图谱特征,表明这类修饰在植物发育中具有关键作用。例如,2 - 羟基异丁酰化修饰在小麦叶片 [30]、幼苗 [31]、根 [11],水稻幼苗 [38]、发育种子 [13] 及花器官 [35] 等组织的组蛋白与非组蛋白上均有检出(见图 5A),暗示其可能参与调控器官形成、生殖生长等发育进程(见图 5B 及表 1)。同理,巴豆酰化修饰在小麦幼苗叶片 [65]、水稻幼苗叶片 [37] 及矮牵牛花冠 [66] 中被鉴定(见图 5A),表明其可能在幼苗早期发育及花器官发育中发挥作用。小麦种子 [32] 与水稻籽粒 [12] 中均检测到组蛋白与非组蛋白的乳酰化修饰蛋白,说明该修饰可能参与种子发育调控;而琥珀酰化修饰在拟南芥叶片 [67]、大麦根 [68,69]、水稻胚胎 [36] 及幼苗 [40] 中均有报道(见图 5A),提示其可能参与胚胎发生与营养生长过程(见表 1)。此外,对霍山石斛 [70]、半夏 [71]、丹参 [72] 等药用植物的研究发现,这些植物中存在独特的酰化修饰图谱,且该特征可能与药用活性成分的生物合成调控相关(见表 1)。
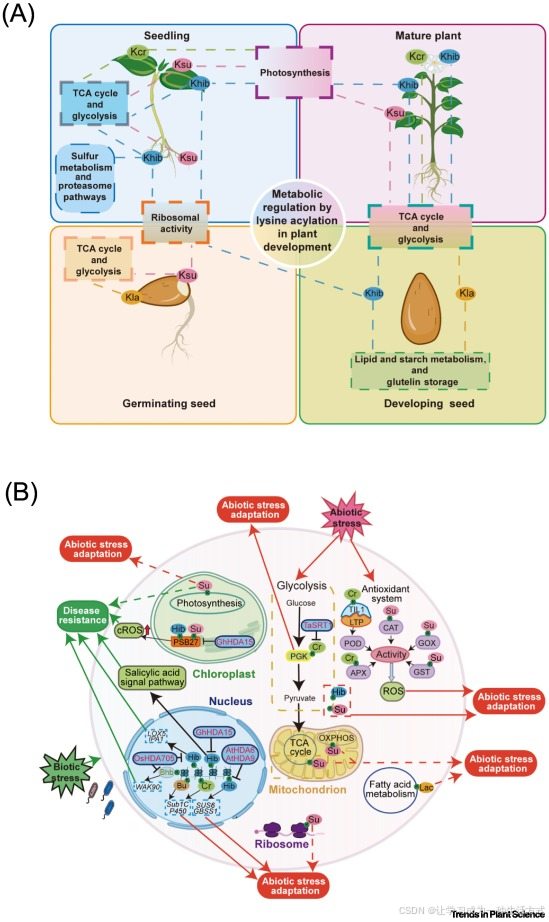
图 5 赖氨酸酰化修饰调控植物发育与逆境适应的分子机制
(A)植物发育过程中赖氨酸酰化修饰的分布特征及生物学功能。赖氨酸酰化修饰广泛分布于植物各组织中,可通过调控三羧酸循环、糖酵解、光合作用等核心代谢通路影响植物发育进程。核糖体蛋白的酰化修饰可改变其蛋白活性,进而调控蛋白质的合成过程。在植物根组织中,赖氨酸酰化修饰与硫代谢及蛋白酶体介导的蛋白降解途径密切相关;而在籽粒及发育中的种子中,酰化修饰蛋白可参与脂类、淀粉的代谢过程以及谷蛋白的积累。不同颜色的圆形代表不同类型的短链酰化修饰。本图中的植物为模式化示意图,不代表某一特定物种。
(B)赖氨酸短链酰化修饰通过对组蛋白与非组蛋白的动态修饰,调控植物的逆境适应性。组蛋白 2 - 羟基异丁酰化(Khib)修饰受组蛋白去乙酰化酶(GhHDA15、OsHDA705、AtHDA9、AtHDA6)调控,可通过调节脂氧合酶 5(LOX5)、理想株型基因 1(IPA1)等免疫相关基因,以及蔗糖合成酶 6(SUS6)、颗粒结合型淀粉合成酶 1(GBSS1)等代谢相关基因的表达水平,参与植物免疫调控,从而增强植物的逆境响应能力。在水稻的病原菌防御过程中,受OsHDA705调控的组蛋白 β- 羟基丁酰化(Kbhb)修饰,可调控细胞壁相关类受体激酶 90(WAK90)等免疫基因的表达。组蛋白丁酰化(Kbu)与巴豆酰化(Kcr)修饰则可直接调控耐淹基因 1C(Sub1C)、细胞色素 P450(P450)等逆境响应基因的表达。
此外,非组蛋白的短链酰化修饰可通过多条通路介导植物的逆境适应与生长发育:光系统修复蛋白 PSB27 的 Khib 与 Ksu 修饰,可诱导叶绿体中活性氧(ROS)的积累,从而增强植物的抗病性,而该过程受到GhHDA15的负调控。在非生物胁迫条件下,糖酵解、三羧酸循环及抗氧化系统相关蛋白的 Kcr、Khib、Ksu 修饰可协同调控植物的环境适应性;乳酰化(Kla)修饰则通过脂肪酸代谢通路影响植物的环境适应能力。
缩略词说明:APX,抗坏血酸过氧化物酶;At,拟南芥;Bhb,β- 羟基丁酰化;Bu,丁酰化;CAT,过氧化氢酶;Cr,巴豆酰化;Gh,陆地棉;GOX,乙醇酸氧化酶;GST,谷胱甘肽 S - 转移酶;Hib,2 - 羟基异丁酰化;Kbhb,赖氨酸 β- 羟基丁酰化;Kbu,赖氨酸丁酰化;Kcr,赖氨酸巴豆酰化;Khib,赖氨酸 2 - 羟基异丁酰化;Kla,赖氨酸乳酰化;Ksu,赖氨酸琥珀酰化;La,乳酰化;Os,水稻;OXPHOS,氧化磷酸化;POD,过氧化物酶;Su,琥珀酰化;Ta,小麦;TCA cycle,三羧酸循环;TIL1,温度诱导脂质运载蛋白 1;TPL,脂质转移蛋白。
Table 1. Summary of acylated lysine proteomes in plant species
|--------------------------|----------------------|----------------------|--------------------------------------------|--------------------------------------------------|--------------------------------------------------|------------------------|
| Species | Tissue/organ | Modification | Biotic stress | Abiotic stress | Number of lysine-acylated proteins/sites | Refs |
| Rice | Leaves | Kbu | − | − | −/4 | [ href="#bb0050" 10] |
| Rice | Leaves | Kcr | − | − | −/45 | [ href="#bb0050" 10] |
| Wheat | Roots | Khib | − | − | 2186/6328 | [ href="#bb0055" 11] |
| Rice | Grains | Kla | − | − | 342/638 | [ href="#bb0060" 12] |
| Rice | Seeds | Khib | − | − | 2512/9916 | [ href="#bb0065" 13] |
| Cotton | Seedlings | Khib | Verticillium dahliae | − − | 1617/4902 | [ href="#bb0070" 14] |
| Cotton | Seedlings | Ksu | Verticillium dahliae | − − | 2517/4427 | [ href="#bb0070" 14] |
| Arabidopsis thaliana | Seeding leaves | Khib | − | Dark | −/41 | [ href="#bb0130" 26] |
| Maize | Stems | Khib | Fusarium graminearum | − | 728/2066 | [ href="#bb0140" 28] |
| Maize | Roots | Kla | − | Drought | 321/607 | [ href="#bb0145" 29] |
| Wheat | Leaves | Khib | − | − | 1104/3004 | [ href="#bb0150" 30] |
| Wheat | Seedling leaves | Khib | − | − | 1074/3348 | [ href="#bb0155" 31] |
| Wheat | Embryos | Kla | − | − | 394/927 | [ href="#bb0160" 32] |
| Rice | Flowers | Khib | Ustilaginoidea virens | − | 964/2891 | [ href="#bb0175" 35] |
| Rice | Seeds | Ksu | − | − | 261/665 | [ href="#bb0180" 36] |
| Rice | Seedling leaves | Kcr | − | − | 690/1265 | [ href="#bb0185" 37] |
| Rice | Seedling leaves | Khib | − | − | 1596/4163 | [ href="#bb0190" 38] |
| Rice | Seedling leaves | Ksu | − | Oxidation | 2593/5502 | [ href="#bb0195" 39] |
| Rice | Seedlings | Ksu | − | − | 346/710 | [ href="#bb0200" 40] |
| Wheat | Seedling leaves | Kcr | − | Cold | 1726/4696 | [ href="#bb0300" 60] |
| wheat | Seedling leaves | Kcr | − | Salt | 471/1290 | [ href="#bb0325" 65] |
| Petunia | Corollas | Kcr | − | − | 1527/4063 | [ href="#bb0330" 66] |
| Arabidopsis thaliana | Leaves | Ksu | Pseudomonas syringae pv. tomato DC3000 | − | 229/527 | [ href="#bb0335" 67] |
| Barley | Roots | Ksu | − | Inorganic phosphate (Pi) starvation and recovery | 884/2840 | [ href="#bb0340" 68] |
| Barley | Roots | Ksu | − | Pi starvation and recovery | 884/2840 | [ href="#bb0345" 69] |
| Dendrobium huoshanense | Whole plant | Kcr | − | − | 1591/4726 | [ href="#bb0350" 70] |
| Pinellia ternata | Leaves | Kcr | − | − | 1006/2106 | [ href="#bb0355" 71] |
| Salvia miltiorrhiza | Hairy roots | Ksu | − | − | 348/566 | [ href="#bb0360" 72] |
| Turnip | Seedling shoots | Ksu | − | Cd | 256/547 | [ href="#bb0390" 78] |
| Arabidopsis thaliana | Siliques | Khib | − | Salt | 1254/3810 | [ href="#bb0135" 27] |
| Chrysanthemum | Leaves | Kcr | − | Cold | 1199/2017 | [ href="#bb0395" 79] |
除组织特异性外,赖氨酸酰化修饰还与核心代谢过程密切相关,包括中心碳代谢与蛋白质生物合成
蛋白质组学数据证实了这一结论 ------2 - 羟基异丁酰化(Khib)、琥珀酰化(Ksu)、乳酰化(Kla)及巴豆酰化(Kcr)修饰频繁靶向三羧酸循环、糖酵解 / 糖异生等通路中的关键酶类 [11,12,13,30,31,32,35,36,38,40,66,69](见图 5A)。例如,磷酸甘油酸激酶(PGK)、甘油醛 - 3 - 磷酸脱氢酶(GAPDH)等关键酶的酰化修饰可调控其催化活性,进而影响植物体内的碳通量分配及发育进程 [30,31,35,38,40,69]。光合作用是另一项受酰化修饰调控的重要生理过程,多种类型的酰化修饰已在不同光合相关蛋白上被检出 [30,31,38,65,67](见图 5A)。例如,核酮糖 - 1,5 - 二磷酸羧化酶 / 加氧酶(RuBisCO)存在多个 2 - 羟基异丁酰化修饰位点,而卡尔文 - 本森循环的关键酶果糖二磷酸醛缩酶 6(FBA6) 则含有多个巴豆酰化修饰位点,这表明酰化修饰可能参与光合效率的调控 [38,65]。
此外,酰化修饰还参与调控蛋白质翻译及物质储存过程。例如,在小麦幼苗叶片 [31]、小麦幼苗根 [11]、水稻幼苗叶片 [38] 及水稻种子 [13,36] 的核糖体蛋白上均检测到 2 - 羟基异丁酰化或琥珀酰化修饰,暗示这类修饰可能在调控核糖体活性与蛋白质生物合成中发挥作用(见图 5A)。在植物根组织中,发生 2 - 羟基异丁酰化修饰的蛋白在硫代谢及蛋白酶体通路中高度富集(见图 5A),表明该修饰可影响植物的养分同化与蛋白质周转 [11]。在籽粒及发育中的种子中,发生 2 - 羟基异丁酰化和乳酰化修饰的蛋白主要参与脂类、淀粉代谢及谷蛋白储存过程(见图 5A),说明酰化修饰能够调控植物的养分积累与种子萌发 [12,13]。
值得注意的是,部分关键蛋白可同时发生多种酰化修饰,这表明不同类型的酰化修饰之间可能存在交互调控作用。例如,小麦叶片中同时带有 2 - 羟基异丁酰化和琥珀酰化修饰的蛋白在核糖体相关通路中显著富集,暗示这两种修饰可协同调控蛋白质合成过程 [30]。同理,核酮糖 - 1,5 - 二磷酸羧化酶 / 加氧酶大亚基(RbcL)存在乙酰化、琥珀酰化及 2 - 羟基异丁酰化的共修饰位点,表明这些修饰的互作可能参与光合效率的精细调控 [31]。在水稻中,对乙酰化修饰组与琥珀酰化修饰组的比较分析显示,超过 70% 的乙酰化蛋白同时发生琥珀酰化修饰,且这类共修饰蛋白多集中于光合作用与中心碳代谢通路,凸显了两种修饰间广泛且潜在的协同调控关系 [39]。此外,淀粉生物合成的限速酶 ------ 腺苷二磷酸葡萄糖焦磷酸化酶小亚基 2(OsAGPS2)存在大量 2 - 羟基异丁酰化、琥珀酰化及乳酰化修饰位点 [12,13],这进一步证实酰化修饰的交互调控网络在植物生长与代谢过程中具有复杂且多层次的调控作用。
综上,赖氨酸酰化修饰广泛存在于植物各组织中,通过调控中心碳代谢、光合作用、蛋白质合成及养分储存等关键生物学过程,参与植物生长发育的调控。许多蛋白可同时携带多种酰化修饰,提示修饰间的复杂交互作用能够精细调控酶活性与细胞功能。尽管当前研究多聚焦于酰化修饰的蛋白质组学鉴定,但未来需整合功能验证、生物化学分析及表观基因组学技术,深入解析酰基转移酶与去酰化酶如何协同调控各类修饰,从而实现对植物生长发育的精准调控。
赖氨酸酰化修饰调控植物的非生物胁迫响应
在动物细胞中,组蛋白酰化修饰已被证实是逆境响应的动态调控因子,可通过介导染色质重塑与细胞代谢的关联发挥作用。在饥饿、损伤等胁迫条件下,特定酰化修饰标记的丰度会显著改变。例如,饥饿胁迫可降低酵母细胞内的组蛋白 2 - 羟基异丁酰化水平,进而重编程细胞代谢并最终缩短时序寿命 [73]。与之相反,在低氧或炎症反应中,细胞内乳酸的积累会诱导组蛋白乳酰化修饰,该修饰可促进伤口愈合及免疫响应相关基因的表达 [74]。这些研究结果表明,组蛋白酰化修饰是一类代谢敏感型表观遗传标记,可通过精细调控基因表达,帮助生物体应对各类环境与生理胁迫。
植物在生长过程中常面临干旱、盐渍、极端温度、养分匮乏等恶劣非生物胁迫,组蛋白酰化修饰已成为植物逆境适应性调控中一个极具研究价值的表观遗传层面。尽管组蛋白乙酰化修饰与逆境响应基因的激活之间的关联早已被证实 [75,76,77],但近年来的研究发现,多种组蛋白酰化修饰均参与非生物胁迫响应的调控 [10,29,68,78]。例如,在水稻中,组蛋白巴豆酰化与丁酰化修饰的水平会随饥饿胁迫(持续黑暗处理)和淹水胁迫发生动态变化,表明其可能通过介导染色质重塑,激活耐淹基因 1C(Sub1C)、细胞色素 P450(P450)等逆境响应基因的转录(见图 5B)[10]。同理,在黑暗诱导的饥饿胁迫下,组蛋白 2 - 羟基异丁酰化修饰参与调控蔗糖合成酶 6(SUS6)、颗粒结合型淀粉合成酶 1(GBSS1)等代谢相关基因的表达,进一步证实组蛋白修饰在植物适应性胁迫响应中的重要性 [26](见图 5B)。此外,植物蛋白质组学分析显示,非组蛋白的赖氨酸短链酰化修饰在非生物胁迫响应中构成了复杂的调控网络。例如,盐胁迫下拟南芥角果中大量蛋白的 2 - 羟基异丁酰化修饰水平显著下调,且受影响的蛋白主要集中于糖酵解通路(见图 5B),这表明酰化修饰可能通过调控代谢重编程来应对胁迫 [27]。在小麦中,低温胁迫可诱导丙酮酸代谢关键酶TaPGK发生巴豆酰化修饰,促进该蛋白的积累并增强植株的耐寒性 [60](见图 5B)。无独有偶,低温胁迫可导致菊花体内的巴豆酰化修饰谱发生广泛变化,且差异修饰蛋白多集中于氧化还原调控通路 [79,80](见图 5B)。值得注意的是,低温诱导的脂质运载蛋白 DgTIL1 在第 72 位赖氨酸位点的巴豆酰化修饰,可通过稳定非特异性脂质转移蛋白 DgnsLTP,促进过氧化物酶的表达与活性,减少活性氧(ROS)的积累,最终增强菊花的耐寒性 [80](见图 5B)。在玉米中,乳酰化修饰同样是调控根系干旱胁迫响应的关键因子,且耐旱与干旱敏感玉米品系的乳酰化修饰组图谱存在明显差异 [29]。例如,干旱胁迫下仅耐旱品系的脂肪酸降解酶乳酰化水平出现下调,同时两个品系中组蛋白乳酰化靶向基因的调控模式也存在差异 [29](见图 5B)。
琥珀酰化作为另一类酰化修饰,在芜菁幼苗响应镉胁迫的过程中发挥作用,可影响光合作用、三羧酸循环及氨基酸代谢相关蛋白的功能 [78](见图 5B)。具体而言,乙醇酸氧化酶(GOX)、过氧化氢酶(CAT)、谷胱甘肽 S - 转移酶(GST)的琥珀酰化修饰水平变化,可通过调控过氧化氢(H₂O₂)积累与谷胱甘肽代谢,参与植物的镉胁迫解毒过程 [78](见图 5B)。在大麦根系中,短期磷饥饿及后续恢复过程可动态重塑琥珀酰化蛋白质组:磷饥饿期间,核糖体通路与糖酵解通路中的蛋白琥珀酰化修饰显著富集;而在恢复阶段,三羧酸循环与氧化磷酸化通路的蛋白琥珀酰化修饰水平明显增强 [69](见图 5B),这表明琥珀酰化修饰在植物应对养分波动的代谢适应中具有重要作用。此外,水稻叶片遭受氧化胁迫时,会触发特定蛋白亚群的去琥珀酰化修饰,例如过氧化氢酶的琥珀酰化水平降低可增强其酶活性 [39](见图 5B),这凸显了酰化修饰对胁迫响应的选择性调控特性。
综上,这些研究结果表明,不同类型的赖氨酸酰化修饰是一类动态且具有适应性的表观遗传标记,可整合代谢信号与环境信号,协同调控植物的逆境响应。随着研究的深入,需进一步明确特定酰化修饰如何调控蛋白功能(包括基因表达、亚细胞定位、蛋白互作、酶活性及信号通路等方面),从而全面解析其在植物非生物胁迫抗性中的功能机制。
赖氨酸酰化修饰调控植物的生物胁迫响应
近期研究还揭示了组蛋白赖氨酸酰化修饰在植物免疫中的关键作用,这类染色质修饰可直接调控防御相关基因的表达。在受到稻曲病菌侵染的水稻中,组蛋白 H4K8 位点的 2 - 羟基异丁酰化修饰在脂氧合酶 5(LOX5)、理想株型基因 1(IPA1)等免疫相关基因的启动子区域富集,进而驱动这些基因的转录激活并增强植株抗病性 [15](见图 5B)。与之类似,水稻受病原菌侵染时,组蛋白 H3K9 位点的 β- 羟基丁酰化修饰在细胞壁相关类受体激酶 90(WAK90)等免疫基因区域被诱导激活 [47](见图 5B)。上述两种修饰均受组蛋白去乙酰化酶 HDA705 的严格调控,该蛋白是这两种修饰的关键去修饰酶------ 编码基因的缺失会导致组蛋白 2 - 羟基异丁酰化与 β- 羟基丁酰化修饰水平升高,同时增强植株的抗病性,从而直接建立起组蛋白酰化修饰动态变化与免疫信号通路的关联 [15,35,47](见图 5B)。同理,在受到禾谷镰孢菌侵染的玉米中,检测到 8 个组蛋白 2 - 羟基异丁酰化位点的修饰水平在侵染后显著升高,这表明组蛋白酰化修饰在植物防御反应中,对病程相关基因的表达调控具有重要作用 [28]。
除组蛋白修饰外,非组蛋白的酰化修饰也被越来越多地证实是调控植物应对病原菌侵染的关键因子。例如,毒性菌株丁香假单胞杆菌番茄致病变种 DC3000侵染拟南芥后,植株内蛋白的琥珀酰化修饰水平显著升高 [67]。对差异琥珀酰化蛋白的功能分析显示,这些蛋白在光合通路中高度富集 [67],表明酰化修饰可能通过关联光合效率与防御响应,参与植物免疫调控。在棉花应对大丽轮枝菌侵染的研究中,2 - 羟基异丁酰化与琥珀酰化修饰的功能分析进一步证实了酰化修饰、光合作用与植物免疫三者间的关联 [14]。该研究发现,两种修饰均与棉花的抗病性密切相关,且组蛋白 2 - 羟基异丁酰化修饰可特异性调控植物免疫相关基因的表达 [14](见图 5B)。尤为重要的是,该研究还发现叶绿体蛋白是这两类酰化修饰的主要靶向对象,并证实组蛋白去乙酰化酶GhHDA15可通过去除 2 - 羟基异丁酰化与琥珀酰化修饰标记,负调控棉花对大丽轮枝菌的抗性 [14](见图 5B)。该调控网络的核心是光系统修复蛋白GhPSB27,其酰化修饰水平的升高可促进光系统 II 核心蛋白 D1 的积累(见图 5B),进而提升光合效率并促进叶绿体来源活性氧的产生,最终实现棉花产量与抗病性的协同提升 [14]。综上,这些研究表明,病原菌诱导的组蛋白与非组蛋白酰化修饰是调控植物防御反应的关键枢纽,可通过协同调控代谢过程与基因表达增强植物抗性;同时也揭示了不同酰化修饰间的互作,构成了植物免疫调控的多层次分子策略。
除组织特异性外,赖氨酸酰化修饰还与核心代谢过程密切相关,包括中心碳代谢与蛋白质生物合成
蛋白质组学数据证实了这一结论 ------2 - 羟基异丁酰化(Khib)、琥珀酰化(Ksu)、乳酰化(Kla)及巴豆酰化(Kcr)修饰频繁靶向三羧酸循环、糖酵解 / 糖异生等通路中的关键酶类 [11,12,13,30,31,32,35,36,38,40,66,69](见图 5A)。例如,磷酸甘油酸激酶(PGK)、甘油醛 - 3 - 磷酸脱氢酶(GAPDH)等关键酶的酰化修饰可调控其催化活性,进而影响植物体内的碳通量分配及发育进程 [30,31,35,38,40,69]。光合作用是另一项受酰化修饰调控的重要生理过程,多种类型的酰化修饰已在不同光合相关蛋白上被检出 [30,31,38,65,67](见图 5A)。例如,核酮糖 - 1,5 - 二磷酸羧化酶 / 加氧酶(RuBisCO)存在多个 2 - 羟基异丁酰化修饰位点,而卡尔文 - 本森循环的关键酶果糖二磷酸醛缩酶 6(FBA6) 则含有多个巴豆酰化修饰位点,这表明酰化修饰可能参与光合效率的调控 [38,65]。
此外,酰化修饰还参与调控蛋白质翻译及物质储存过程。例如,在小麦幼苗叶片 [31]、小麦幼苗根 [11]、水稻幼苗叶片 [38] 及水稻种子 [13,36] 的核糖体蛋白上均检测到 2 - 羟基异丁酰化或琥珀酰化修饰,暗示这类修饰可能在调控核糖体活性与蛋白质生物合成中发挥作用(见图 5A)。在植物根组织中,发生 2 - 羟基异丁酰化修饰的蛋白在硫代谢及蛋白酶体通路中高度富集(见图 5A),表明该修饰可影响植物的养分同化与蛋白质周转 [11]。在籽粒及发育中的种子中,发生 2 - 羟基异丁酰化和乳酰化修饰的蛋白主要参与脂类、淀粉代谢及谷蛋白储存过程(见图 5A),说明酰化修饰能够调控植物的养分积累与种子萌发 [12,13]。
值得注意的是,部分关键蛋白可同时发生多种酰化修饰,这表明不同类型的酰化修饰之间可能存在交互调控作用。例如,小麦叶片中同时带有 2 - 羟基异丁酰化和琥珀酰化修饰的蛋白在核糖体相关通路中显著富集,暗示这两种修饰可协同调控蛋白质合成过程 [30]。同理,核酮糖 - 1,5 - 二磷酸羧化酶 / 加氧酶大亚基(RbcL)存在乙酰化、琥珀酰化及 2 - 羟基异丁酰化的共修饰位点,表明这些修饰的互作可能参与光合效率的精细调控 [31]。在水稻中,对乙酰化修饰组与琥珀酰化修饰组的比较分析显示,超过 70% 的乙酰化蛋白同时发生琥珀酰化修饰,且这类共修饰蛋白多集中于光合作用与中心碳代谢通路,凸显了两种修饰间广泛且潜在的协同调控关系 [39]。此外,淀粉生物合成的限速酶 ------ 腺苷二磷酸葡萄糖焦磷酸化酶小亚基 2(OsAGPS2)存在大量 2 - 羟基异丁酰化、琥珀酰化及乳酰化修饰位点 [12,13],这进一步证实酰化修饰的交互调控网络在植物生长与代谢过程中具有复杂且多层次的调控作用。
综上,赖氨酸酰化修饰广泛存在于植物各组织中,通过调控中心碳代谢、光合作用、蛋白质合成及养分储存等关键生物学过程,参与植物生长发育的调控。许多蛋白可同时携带多种酰化修饰,提示修饰间的复杂交互作用能够精细调控酶活性与细胞功能。尽管当前研究多聚焦于酰化修饰的蛋白质组学鉴定,但未来需整合功能验证、生物化学分析及表观基因组学技术,深入解析酰基转移酶与去酰化酶如何协同调控各类修饰,从而实现对植物生长发育的精准调控。
赖氨酸酰化修饰调控植物的非生物胁迫响应
在动物细胞中,组蛋白酰化修饰已被证实是逆境响应的动态调控因子,可通过介导染色质重塑与细胞代谢的关联发挥作用。在饥饿、损伤等胁迫条件下,特定酰化修饰标记的丰度会显著改变。例如,饥饿胁迫可降低酵母细胞内的组蛋白 2 - 羟基异丁酰化水平,进而重编程细胞代谢并最终缩短时序寿命 [73]。与之相反,在低氧或炎症反应中,细胞内乳酸的积累会诱导组蛋白乳酰化修饰,该修饰可促进伤口愈合及免疫响应相关基因的表达 [74]。这些研究结果表明,组蛋白酰化修饰是一类代谢敏感型表观遗传标记,可通过精细调控基因表达,帮助生物体应对各类环境与生理胁迫。
植物在生长过程中常面临干旱、盐渍、极端温度、养分匮乏等恶劣非生物胁迫,组蛋白酰化修饰已成为植物逆境适应性调控中一个极具研究价值的表观遗传层面。尽管组蛋白乙酰化修饰与逆境响应基因的激活之间的关联早已被证实 [75,76,77],但近年来的研究发现,多种组蛋白酰化修饰均参与非生物胁迫响应的调控 [10,29,68,78]。例如,在水稻中,组蛋白巴豆酰化与丁酰化修饰的水平会随饥饿胁迫(持续黑暗处理)和淹水胁迫发生动态变化,表明其可能通过介导染色质重塑,激活耐淹基因 1C(Sub1C)、细胞色素 P450(P450)等逆境响应基因的转录(见图 5B)[10]。同理,在黑暗诱导的饥饿胁迫下,组蛋白 2 - 羟基异丁酰化修饰参与调控蔗糖合成酶 6(SUS6)、颗粒结合型淀粉合成酶 1(GBSS1)等代谢相关基因的表达,进一步证实组蛋白修饰在植物适应性胁迫响应中的重要性 [26](见图 5B)。此外,植物蛋白质组学分析显示,非组蛋白的赖氨酸短链酰化修饰在非生物胁迫响应中构成了复杂的调控网络。例如,盐胁迫下拟南芥角果中大量蛋白的 2 - 羟基异丁酰化修饰水平显著下调,且受影响的蛋白主要集中于糖酵解通路(见图 5B),这表明酰化修饰可能通过调控代谢重编程来应对胁迫 [27]。在小麦中,低温胁迫可诱导丙酮酸代谢关键酶TaPGK发生巴豆酰化修饰,促进该蛋白的积累并增强植株的耐寒性 [60](见图 5B)。无独有偶,低温胁迫可导致菊花体内的巴豆酰化修饰谱发生广泛变化,且差异修饰蛋白多集中于氧化还原调控通路 [79,80](见图 5B)。值得注意的是,低温诱导的脂质运载蛋白 DgTIL1 在第 72 位赖氨酸位点的巴豆酰化修饰,可通过稳定非特异性脂质转移蛋白 DgnsLTP,促进过氧化物酶的表达与活性,减少活性氧(ROS)的积累,最终增强菊花的耐寒性 [80](见图 5B)。在玉米中,乳酰化修饰同样是调控根系干旱胁迫响应的关键因子,且耐旱与干旱敏感玉米品系的乳酰化修饰组图谱存在明显差异 [29]。例如,干旱胁迫下仅耐旱品系的脂肪酸降解酶乳酰化水平出现下调,同时两个品系中组蛋白乳酰化靶向基因的调控模式也存在差异 [29](见图 5B)。
琥珀酰化作为另一类酰化修饰,在芜菁幼苗响应镉胁迫的过程中发挥作用,可影响光合作用、三羧酸循环及氨基酸代谢相关蛋白的功能 [78](见图 5B)。具体而言,乙醇酸氧化酶(GOX)、过氧化氢酶(CAT)、谷胱甘肽 S - 转移酶(GST)的琥珀酰化修饰水平变化,可通过调控过氧化氢(H₂O₂)积累与谷胱甘肽代谢,参与植物的镉胁迫解毒过程 [78](见图 5B)。在大麦根系中,短期磷饥饿及后续恢复过程可动态重塑琥珀酰化蛋白质组:磷饥饿期间,核糖体通路与糖酵解通路中的蛋白琥珀酰化修饰显著富集;而在恢复阶段,三羧酸循环与氧化磷酸化通路的蛋白琥珀酰化修饰水平明显增强 [69](见图 5B),这表明琥珀酰化修饰在植物应对养分波动的代谢适应中具有重要作用。此外,水稻叶片遭受氧化胁迫时,会触发特定蛋白亚群的去琥珀酰化修饰,例如过氧化氢酶的琥珀酰化水平降低可增强其酶活性 [39](见图 5B),这凸显了酰化修饰对胁迫响应的选择性调控特性。
综上,这些研究结果表明,不同类型的赖氨酸酰化修饰是一类动态且具有适应性的表观遗传标记,可整合代谢信号与环境信号,协同调控植物的逆境响应。随着研究的深入,需进一步明确特定酰化修饰如何调控蛋白功能(包括基因表达、亚细胞定位、蛋白互作、酶活性及信号通路等方面),从而全面解析其在植物非生物胁迫抗性中的功能机制。
赖氨酸酰化修饰调控植物的生物胁迫响应
近期研究还揭示了组蛋白赖氨酸酰化修饰在植物免疫中的关键作用,这类染色质修饰可直接调控防御相关基因的表达。在受到稻曲病菌侵染的水稻中,组蛋白 H4K8 位点的 2 - 羟基异丁酰化修饰在脂氧合酶 5(LOX5)、理想株型基因 1(IPA1)等免疫相关基因的启动子区域富集,进而驱动这些基因的转录激活并增强植株抗病性 [15](见图 5B)。与之类似,水稻受病原菌侵染时,组蛋白 H3K9 位点的 β- 羟基丁酰化修饰在细胞壁相关类受体激酶 90(WAK90)等免疫基因区域被诱导激活 [47](见图 5B)。上述两种修饰均受组蛋白去乙酰化酶 HDA705 的严格调控,该蛋白是这两种修饰的关键去修饰酶------ 编码基因的缺失会导致组蛋白 2 - 羟基异丁酰化与 β- 羟基丁酰化修饰水平升高,同时增强植株的抗病性,从而直接建立起组蛋白酰化修饰动态变化与免疫信号通路的关联 [15,35,47](见图 5B)。同理,在受到禾谷镰孢菌侵染的玉米中,检测到 8 个组蛋白 2 - 羟基异丁酰化位点的修饰水平在侵染后显著升高,这表明组蛋白酰化修饰在植物防御反应中,对病程相关基因的表达调控具有重要作用 [28]。
除组蛋白修饰外,非组蛋白的酰化修饰也被越来越多地证实是调控植物应对病原菌侵染的关键因子。例如,毒性菌株丁香假单胞杆菌番茄致病变种 DC3000侵染拟南芥后,植株内蛋白的琥珀酰化修饰水平显著升高 [67]。对差异琥珀酰化蛋白的功能分析显示,这些蛋白在光合通路中高度富集 [67],表明酰化修饰可能通过关联光合效率与防御响应,参与植物免疫调控。在棉花应对大丽轮枝菌侵染的研究中,2 - 羟基异丁酰化与琥珀酰化修饰的功能分析进一步证实了酰化修饰、光合作用与植物免疫三者间的关联 [14]。该研究发现,两种修饰均与棉花的抗病性密切相关,且组蛋白 2 - 羟基异丁酰化修饰可特异性调控植物免疫相关基因的表达 [14](见图 5B)。尤为重要的是,该研究还发现叶绿体蛋白是这两类酰化修饰的主要靶向对象,并证实组蛋白去乙酰化酶GhHDA15可通过去除 2 - 羟基异丁酰化与琥珀酰化修饰标记,负调控棉花对大丽轮枝菌的抗性 [14](见图 5B)。该调控网络的核心是光系统修复蛋白GhPSB27,其酰化修饰水平的升高可促进光系统 II 核心蛋白 D1 的积累(见图 5B),进而提升光合效率并促进叶绿体来源活性氧的产生,最终实现棉花产量与抗病性的协同提升 [14]。综上,这些研究表明,病原菌诱导的组蛋白与非组蛋白酰化修饰是调控植物防御反应的关键枢纽,可通过协同调控代谢过程与基因表达增强植物抗性;同时也揭示了不同酰化修饰间的互作,构成了植物免疫调控的多层次分子策略。
赖氨酸酰化修饰调控植物的生物胁迫响应
近期研究进一步揭示,组蛋白赖氨酸酰化修饰在植物免疫中发挥关键作用,这类染色质修饰可直接介导防御相关基因的表达调控。在遭受稻曲病菌(Ustilaginoidea virens)侵染的水稻中,组蛋白 H4K8 位点的 2 - 羟基异丁酰化修饰(H4K8hib)会在脂氧合酶 5(LOX5)、理想株型基因 1(IPA1)等免疫相关基因的启动子区域富集,进而驱动这些基因的转录激活,增强植株抗病性 [15](见图 5B)。与之类似,水稻受病原菌侵染时,细胞壁相关类受体激酶 90(WAK90)等免疫基因区域的组蛋白 H3K9 位点 β- 羟基丁酰化修饰(H3K9bhb)也会被诱导激活 [47](见图 5B)。上述两种修饰均受组蛋白去乙酰化酶 HDA705 的严格调控,该蛋白是这两类修饰的核心去修饰酶------ 编码基因的缺失会导致组蛋白 2 - 羟基异丁酰化(Khib)与 β- 羟基丁酰化(Kbhb)修饰水平显著升高,同时增强植株抗病性,从而直接建立起组蛋白酰化修饰动态变化与免疫信号通路的关联 [15,35,47](见图 5B)。同理,在禾谷镰孢菌(Fusarium graminearum)侵染的玉米中,共检测到 8 个组蛋白 2 - 羟基异丁酰化修饰位点,其修饰水平在侵染后显著上调,这表明组蛋白酰化修饰在植物防御反应中,对病程相关基因的表达调控具有重要作用 [28]。
除组蛋白修饰外,非组蛋白的酰化修饰也被越来越多地证实是调控植物应对病原菌侵染的关键因子。例如,毒性菌株丁香假单胞杆菌番茄致病变种 DC3000(Pseudomonas syringae pv. tomato DC3000)侵染拟南芥后,植株内蛋白质的琥珀酰化(Ksu)修饰水平显著升高 [67]。对差异琥珀酰化蛋白的功能分析显示,这些蛋白在光合通路中高度富集 [67],表明酰化修饰可能通过关联光合效率与防御响应,参与植物免疫调控。在棉花响应大丽轮枝菌(Verticillium dahliae)侵染的研究中,2 - 羟基异丁酰化与琥珀酰化修饰的功能分析进一步证实了酰化修饰、光合作用与植物免疫三者间的关联 [14]。该研究发现,两种修饰均与棉花抗病性密切相关,且组蛋白 2 - 羟基异丁酰化修饰可特异性调控植物免疫相关基因的表达 [14](见图 5B)。尤为重要的是,该研究还发现叶绿体蛋白是这两类酰化修饰的主要靶向对象,并证实组蛋白去乙酰化酶GhHDA15可通过发挥去修饰酶活性、移除 2 - 羟基异丁酰化与琥珀酰化修饰标记,负调控棉花对大丽轮枝菌的抗性 [14](见图 5B)。该调控网络的核心是光系统修复蛋白GhPSB27,其酰化修饰水平的升高可促进光系统 II 核心蛋白 D1 的积累(见图 5B),进而提升光合效率并促进叶绿体来源活性氧(ROS)的产生,最终实现棉花产量与抗病性的协同提升 [14]。综上,这些研究表明,病原菌诱导的组蛋白与非组蛋白酰化修饰是调控植物防御反应的关键枢纽,可通过协同调控代谢过程与基因表达增强植物抗性;同时也揭示,不同类型酰化修饰间的互作构成了植物免疫调控的多层次分子机制。
研究挑战与未来方向
尽管学界对植物组蛋白酰化修饰及其生物学功能的关注度日益提升,但目前的认知仍处于起步阶段。下文将探讨该领域亟待解决的关键挑战与未来研究方向。
赖氨酸酰化修饰与乙酰化修饰的交互调控
该领域最亟待解答的科学问题之一,是不同类型组蛋白酰化修饰间的功能交互,尤其是植物中这些新型酰化修饰与经典乙酰化修饰的互作模式。许多组蛋白赖氨酸残基可作为多种酰基的潜在修饰底物,这增加了修饰间发生竞争或协同调控的可能性。目前尚不明确,针对特定基因组位点,不同类型的酰化修饰是发挥冗余功能、按序调控,还是存在拮抗作用。解析这一调控层级关系 ------ 具体而言,即一种组蛋白酰化修饰标记如何介导或抑制另一种修饰的形成,是阐明组蛋白密码组合调控逻辑的关键。除组蛋白外,核酮糖 - 1,5 - 二磷酸羧化酶 / 加氧酶(RuBisCO)、腺苷二磷酸葡萄糖焦磷酸化酶等非组蛋白同样存在乙酰化、琥珀酰化、2 - 羟基异丁酰化或乳酰化的共修饰位点 [12,13,31,39],这表明不同酰化修饰间可能存在交互调控,并参与酶活性与代谢过程的调节。阐明这些互作机制,将有助于揭示酰化修饰网络如何协同调控代谢过程,进而实现对植物生长发育与逆境响应的精准调控。
植物组蛋白酰化修饰的代谢调控机制
与动物不同,植物作为自养型生物,可通过光合作用及其他代谢途径合成代谢物,这赋予了植物独特的代谢灵活性。这一特性为组蛋白酰化修饰调控增添了独特层面 ------ 光照、养分有效性、胁迫等环境因子可直接影响细胞内酰基辅酶 A 供体的水平,进而塑造组蛋白酰化修饰图谱。例如,植物细胞内乙酰辅酶 A 水平的代谢调控与组蛋白乙酰化修饰的动态变化密切相关 [81,82]。将这一研究延伸至巴豆酰辅酶 A、琥珀酰辅酶 A、2 - 羟基异丁酰辅酶 A 等其他酰基辅酶 A 供体,将为该领域开辟全新的研究方向。解析初级代谢与染色质调控的整合机制,有望揭示植物如何通过表观遗传可塑性协同调控生长发育与逆境响应。
植物组蛋白赖氨酸酰化修饰识别蛋白的鉴定
组蛋白修饰需由特异性识别蛋白(reader) 识别并解读,这类蛋白可结合特定酰基修饰标记,进而招募下游效应因子调控染色质动态变化与基因表达。例如,在组蛋白乙酰化修饰的调控中,含溴结构域的蛋白是一类研究明确的识别蛋白,可特异性结合乙酰化赖氨酸残基,参与转录调控 [83]。动物细胞中已鉴定出多种酰化修饰识别蛋白,包括含溴结构域与 YEATS 结构域的蛋白家族 [84,85],这些结构域可识别巴豆酰化等多种酰化修饰标记 [85]。相比之下,尽管植物中组蛋白赖氨酸短链酰化修饰的研究日益丰富,但迄今尚未鉴定出专门的酰化修饰识别蛋白。基于动物研究的启示,植物中可能存在同源蛋白 ------ 这类蛋白可能含有溴结构域、植物同源结构域(PHD)指状结构或 YEATS 结构域,能够识别这些新型酰化修饰标记,并将代谢信号整合至染色质调控网络中。鉴定植物中的酰化修饰识别蛋白,是该领域的关键挑战,也是极具前景的研究方向。这一研究不仅能大幅深化我们对植物发育与逆境响应表观遗传调控机制的认知,更具有重要的理论价值。
研究展望
植物表观遗传学研究正逐步揭示,组蛋白与非组蛋白的酰化修饰事件构成了一个远比以往认知更具多样性与复杂性的调控网络(详见关键科学问题)。该领域的研究重点应包括:开发植物特异性抗体与质谱技术,实现低丰度酰化修饰标记的精准检测;鉴定新型催化酶(writer)、去修饰酶(eraser)与识别蛋白(reader);通过遗传学与生物化学手段,解析这些调控元件的生物学功能。鉴于植物独特的代谢通路,未来有望从机制层面建立细胞代谢与染色质动态变化的关联,并将研究成果应用于农业生产实践。解析植物组蛋白酰化修饰的功能,不仅能深化我们对基础生物学问题的认知,更有望通过表观基因组编辑与代谢重编程技术,为作物抗逆性与产量的改良提供创新策略。
关键科学问题
组蛋白短链酰化修饰如何精准调控基因表达或染色质动态变化,进而影响植物生长发育进程?
酰基辅酶 A 供体的生物合成与供给,如何响应发育信号与环境胁迫的调控?
组蛋白短链酰化修饰是否存在组织或细胞类型特异性的分布模式?其时空动态变化如何调控不同植物组织的发育可塑性?
不同类型组蛋白短链酰化修饰间是否存在功能互作或层级调控关系?它们是竞争共用的赖氨酸修饰位点,还是协同调控转录程序?