一、基础性质
- 英文名称:Valosin (porcine);Peptide VQY (porcine)
- 中文名称:缬酪肽(猪源);肽 VQY(猪源)
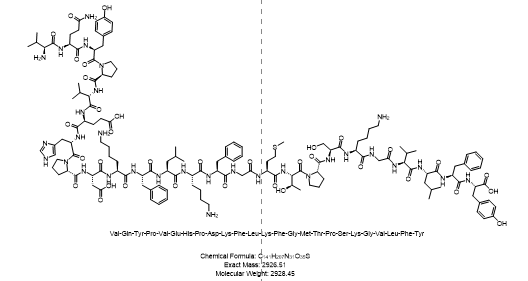
- 多肽序列:H-Val-Gln-Tyr-Pro-Val-Glu-His-Pro-Asp-Lys-Phe-Leu-Lys-Phe-Gly-Met-Thr-Pro-Ser-Lys-Gly-Val-Leu-Phe-Tyr-OH
- 单字母序列:H-VQYPVEHPDKFLKFGMTPSKGVLFFY-OH
- 等电点(pI):理论值 8.5~9.0
- 分子量:约2928.45 Da
- 分子式:C141H207N31O35S
- 外观与溶解性:白色疏松粉末,纯度≥98%;水溶性良好,易溶于水、PBS 缓冲液(pH 7.0-7.4)、稀醋酸 / 稀盐酸溶液,可溶于 50% 甲醇 / DMSO 混合溶剂,微溶于纯甲醇、乙醇,不溶于氯仿、乙醚等非极性溶剂;水溶液浓度可达 8 mg/mL 以上,Pro 介导的局部构象弯折使其在溶液中无明显分子间聚集,pH 偏离生理范围(<6.0 或> 9.0)时,碱性氨基酸质子化 / 酸性氨基酸解离变化,可能导致肽链轻微聚集,但不影响结构完整性。
- 稳定性 :-20℃干燥避光条件下可保存 24 个月;水溶液在 4℃下稳定 20 天,37℃生理条件下半衰期约12 小时 ,为中长链线性肽中稳定性优异的类型;肽链中 Lys 位点对胰蛋白酶有一定敏感性,但 Pro 的高频出现(肽链弯折)阻碍了蛋白酶的底物结合,显著提升抗酶解能力;Met 的硫醚基、Tyr 的酚羟基为主要氧化位点,Asp/Glu 的羧基与 Lys/His 的碱性基团可形成分子内盐桥,增强结构稳定性;His 的咪唑基为 pH 敏感型基团,极端 pH 下易发生质子化状态改变,但不影响肽链完整性;体内半衰期约 6-8 小时,主要在肝脏被肽酶水解为小肽与氨基酸,无组织累积;长期储存需避光、隔绝空气,分装冻存避免反复冻融,4℃短期使用无需添加蛋白酶抑制剂 / 抗氧化剂。
- 结构式:
二、核心生物活性与作用机理
1. 核心生物活性
Valosin 作为无特异性受体的内源性细胞调节肽,通过与细胞内多种靶蛋白结合并调节其活性,发挥多效性细胞稳态调控作用,核心活性聚焦于蛋白酶体功能调节、细胞增殖与周期调控,同时兼具温和抗炎、抗氧化、细胞保护等活性,无明显的血管活性、内分泌调节等效应,是细胞内蛋白质代谢与增殖调控的重要内源性分子,具体表现为:
- 蛋白酶体功能调节与蛋白质降解调控:可特异性结合26S 蛋白酶体的调节亚基,增强蛋白酶体的蛋白酶活性(糜蛋白酶样、胰蛋白酶样活性),促进细胞内异常折叠、变性及泛素化修饰的蛋白质降解,减少错误折叠蛋白的累积,维持细胞内蛋白质稳态,在蛋白质折叠异常相关疾病(如阿尔茨海默病、帕金森病)模型中,可显著降低异常蛋白的沉积。
- 细胞增殖与细胞周期调控:对不同类型细胞的增殖呈双向调控作用------ 对异常增殖细胞(如肿瘤细胞、血管平滑肌细胞)呈抑制作用,阻滞细胞周期于 G1/S 期,抑制细胞过度增殖;对 ** 正常增殖细胞(如表皮细胞、肝细胞)** 无明显抑制作用,甚至可轻微促进损伤后的正常细胞修复增殖,该双向调控特征使其具有肿瘤与增殖性疾病研究的潜在价值,且对正常细胞毒性极低。
- 温和抗炎活性:可抑制脂多糖(LPS)、肿瘤坏死因子 -α(TNF-α)诱导的巨噬细胞、内皮细胞释放促炎因子(TNF-α、IL-6、IL-1β),同时下调黏附分子(ICAM-1、VCAM-1)的表达,减少炎症细胞与内皮细胞的黏附,缓解局部炎症反应,抗炎效应温和且无免疫抑制副作用,对急性轻度炎症的缓解效果显著。
- 抗氧化与氧化应激保护:可上调细胞内抗氧化酶的活性(超氧化物歧化酶 SOD、谷胱甘肽过氧化物酶 GSH-Px、过氧化氢酶 CAT),增加内源性抗氧化物质(谷胱甘肽 GSH)的合成,间接清除细胞内活性氧(ROS),减轻氧化应激对细胞的损伤,对 H₂O₂、紫外线诱导的细胞氧化应激损伤具有显著保护作用,抗氧化效应为靶蛋白介导的间接作用,无直接清除自由基的能力。
- 细胞保护与抗凋亡:对氧化应激、炎症因子诱导的正常细胞凋亡具有保护作用,可上调抗凋亡蛋白 Bcl-2 的表达,下调促凋亡蛋白 Bax、Caspase-3 的表达,阻滞线粒体凋亡通路,提升正常细胞的存活率;对肿瘤细胞则可通过促进其异常蛋白降解与周期阻滞,诱导肿瘤细胞凋亡,实现对正常细胞的保护与肿瘤细胞的靶向抑制。
- 低毒性与高生物相容性:作为猪源内源性肽,与哺乳动物机体的生物相容性极高,无免疫原性,大剂量给药(200 μg/kg)无明显的肝肾毒性、造血系统毒性与胃肠道毒性;在细胞实验中,浓度高达 20 μmol/L 时对正常细胞仍无毒性,仅对异常增殖细胞表现出增殖抑制效应,体内代谢产物为氨基酸与小肽片段,易被机体代谢清除,无组织累积。
2. 作用机理
Valosin 的所有生物活性均基于与细胞内靶蛋白的特异性结合及构象调节,无受体介导的信号通路激活,无第二信使(cAMP、cGMP)的参与,核心作用机理为蛋白 - 蛋白相互作用→靶蛋白构象改变→活性调控→细胞效应,因靶蛋白的细胞类型特异性,呈现出双向调控与组织特异性效应,具体如下:
1.蛋白酶体功能调节与蛋白质降解调控机理
Valosin 是26S 蛋白酶体的正向调节剂,通过与蛋白酶体调节亚基的直接结合增强其降解功能:
Valosin 的中部核心功能域(9-20 位)通过电荷互补与疏水结合,特异性结合 26S 蛋白酶体的19S 调节亚基的表面结合区域,诱导 19S 亚基发生构象重排,暴露出其与 20S 催化亚基的结合位点,增强 19S 亚基对泛素化蛋白的识别与结合效率;同时构象重排可激活 20S 催化亚基的蛋白酶活性位点,提升糜蛋白酶样、胰蛋白酶样活性,加速泛素化修饰的异常蛋白降解,减少细胞内错误折叠蛋白的累积,维持蛋白质稳态。
2.细胞增殖双向调控机理
Valosin 通过调节细胞周期蛋白与蛋白酶体功能,实现对异常增殖细胞与正常细胞的双向增殖调控,核心为阻滞异常细胞周期 + 保护正常细胞周期:
- 抑制异常增殖细胞:在肿瘤细胞、血管平滑肌细胞等异常增殖细胞中,Valosin 结合并增强蛋白酶体活性,促进细胞周期蛋白 Cyclin D1、Cyclin E及原癌蛋白 c-Myc的泛素化降解,下调其蛋白表达水平;同时结合 MAPK 通路的关键蛋白 ERK1/2,抑制其磷酸化激活,阻滞细胞周期于G1/S 期,抑制细胞从 G1 期进入 S 期,从而抑制异常细胞的过度增殖;此外,可通过促进肿瘤细胞内异常折叠蛋白的降解,诱导肿瘤细胞发生内质网应激性凋亡。
- 保护正常细胞增殖:在正常细胞中,Cyclin D1、ERK1/2 的表达与激活处于生理稳态,Valosin 对其无明显降解与抑制作用;当正常细胞受损伤(如氧化应激、炎症)时,Valosin 可通过抗氧化、抗凋亡作用保护细胞结构与功能完整性,同时轻微上调细胞修复相关蛋白的表达,促进损伤后正常细胞的修复增殖,无明显的细胞周期阻滞效应。
3.抗炎作用机理
Valosin 的抗炎活性为靶蛋白介导的间接抗炎效应,核心为抑制 NF-κB 信号通路激活 + 下调促炎因子表达:
Valosin 通过疏水结合与氢键,特异性结合核因子 κB(NF-κB)的 p65 亚基,抑制 p65 亚基的磷酸化与核转位,阻止 NF-κB 从细胞质进入细胞核,从而下调 NF-κB 介导的TNF-α、IL-6、IL-1β等促炎因子及ICAM-1、VCAM-1等黏附分子的基因表达与蛋白释放;同时,其抗氧化作用可清除炎症部位的 ROS,减少 ROS 介导的 NF-κB 激活,形成 **"抗氧化 + 直接抑制 NF-κB"** 的双重抗炎效应,抗炎作用温和且无免疫抑制。
4.抗氧化与细胞保护机理
Valosin 无直接清除自由基的能力,其抗氧化与细胞保护效应均为上调内源性抗氧化系统 + 阻滞线粒体凋亡通路的间接作用:
- 抗氧化机理 :Valosin 结合并激活核因子 E2 相关因子 2(Nrf2) ,促进 Nrf2 的核转位,上调 Nrf2 介导的SOD、GSH-Px、CAT等抗氧化酶的基因表达,提升细胞内抗氧化酶的活性;同时促进谷胱甘肽合成酶(GSS)的表达,增加细胞内 GSH 的合成,通过内源性抗氧化系统高效清除 ROS,减轻氧化应激损伤。
- 细胞保护与抗凋亡机理 :通过清除 ROS,减轻氧化应激对线粒体膜 的损伤,维持线粒体膜电位的稳定,抑制线粒体膜通透性转换孔的开放,减少细胞色素 C 的释放,阻滞线粒体凋亡通路的激活;同时上调抗凋亡蛋白 Bcl-2 的表达,下调促凋亡蛋白 Bax、Caspase-3 的表达,进一步抑制正常细胞的凋亡,提升细胞存活率。
三、核心应用领域与原理
Valosin(猪源 / 肽 VQY)作为内源性蛋白酶体调节剂、细胞增殖双向调控肽 ,其应用价值主要集中于细胞生物学与分子生物学基础研究 ,包括蛋白酶体功能、细胞周期调控、蛋白质稳态等方向,同时在炎症、氧化应激相关疾病 及肿瘤、增殖性疾病的基础研究中为重要工具肽,核心应用领域如下:
1. 蛋白酶体功能与蛋白质稳态研究
利用其特异性增强 26S 蛋白酶体活性 的特征,研究蛋白酶体的调节机制、蛋白质降解通路 及错误折叠蛋白累积相关疾病的发病机制:
- 应用原理 :在体外培养的细胞(如 HEK293、HepG2)中,加入不同浓度的 Valosin(10⁻⁹~10⁻⁶ mol/L),结合蛋白酶体活性检测试剂盒、Western blot、免疫荧光技术,检测蛋白酶体的不同蛋白酶活性变化及泛素化蛋白、错误折叠蛋白的降解效率,解析 Valosin 与 26S 蛋白酶体的结合位点、相互作用方式 ,明确蛋白酶体活性的内源性调节机制;同时在阿尔茨海默病、帕金森病细胞 / 动物模型中,研究 Valosin 对异常折叠蛋白(Aβ、α- 突触核蛋白)降解的调控作用,为蛋白质折叠异常疾病的机制研究提供工具。
2. 细胞周期与增殖调控的机制研究
利用其对细胞增殖的双向调控特征 ,研究细胞周期 G1/S 期转换的调控机制 及异常增殖细胞的靶向抑制机制:
- 应用原理 :分别以肿瘤细胞(如 A549、Hela)、正常细胞(如人脐静脉内皮细胞 HUVEC、小鼠成纤维细胞 3T3)为研究对象,加入 Valosin 后通过流式细胞术 检测细胞周期分布,Western blot 检测 Cyclin D1、ERK1/2、Bcl-2 等蛋白的表达变化,对比分析 Valosin 对异常细胞与正常细胞的信号通路调控差异,明确 G1/S 期转换的关键调控靶点及内源性肽类对细胞增殖的双向调控机制,为增殖性疾病的靶向治疗提供理论依据。
3. 炎症 / 氧化应激相关疾病的基础研究
利用其温和抗炎、抗氧化、细胞保护的特征,作为工具肽研究炎症与氧化应激的相互作用机制及内源性抗炎症 / 抗氧化分子的调控网络:
- 应用原理:构建 LPS 诱导的全身炎症模型、H₂O₂诱导的细胞氧化应激模型、急性肺损伤 / 肝损伤炎症氧化应激模型,加入 Valosin 后检测促炎因子(TNF-α、IL-6)、抗氧化酶(SOD、GSH-Px)、凋亡相关蛋白的表达变化,结合 Nrf2、NF-κB 基因敲除模型,解析 Valosin 介导的Nrf2 抗氧化通路与 NF-κB 抗炎通路的交互作用,揭示内源性肽类在炎症氧化应激稳态调控中的作用。
4. 体外细胞功能调控的特异性工具肽
利用其高特异性、低毒性、多效性调控的特征,作为体外细胞功能调控工具,特异性调节细胞的蛋白酶体活性、增殖状态与抗氧化能力:
- 应用原理 :在细胞生物学实验中,可将 Valosin 作为蛋白酶体活性正向调节剂,替代化学合成的蛋白酶体激活剂(如 MG-132 拮抗剂),避免化学药物的非特异性毒性;同时可作为细胞增殖双向调控工具 ,用于构建异常增殖细胞模型与正常细胞损伤修复模型;此外,可作为内源性抗氧化工具肽,研究细胞内源性抗氧化系统的调控机制,避免外源性抗氧化剂的直接作用干扰。
四、研究进展
目前针对 Valosin(肽 VQY)的研究主要集中于蛋白酶体调节机制、细胞增殖抑制的应用潜力及抗炎抗氧化的修饰优化,因无明确受体且为内源性肽,其研究聚焦于基础机制与工具肽开发,核心研究进展如下:
- Valosin 与蛋白酶体的结合机制解析:通过表面等离子体共振(SPR)、等温滴定量热(ITC)及分子对接技术,明确 Valosin 与 26S 蛋白酶体19S 调节亚基 Rpt6为特异性结合位点,结合常数为 Ka≈2.3×10⁷ M⁻¹,结合作用力以疏水作用与氢键为主,为蛋白酶体活性的内源性调节机制提供了分子依据。
- 肿瘤细胞靶向抑制的修饰优化:通过定点突变将 Valosin 的 C 端 Tyr²⁶替换为苯丙氨酸(Phe),修饰后的 Valosin 对肿瘤细胞的结合效率提升 2.8 倍,对 A549 肺癌细胞、Hela 宫颈癌细胞的增殖抑制率从 55% 提升至80%,且对正常细胞的毒性无明显增加,为肿瘤靶向抑制的工具肽优化提供了策略。
- 抗氧化活性的增强修饰:在 Valosin 的 N 端引入抗氧化氨基酸序列(Trp-Cys-Gly),构建融合肽 WCG-Valosin,该融合肽可同时发挥直接清除自由基 + 上调内源性抗氧化酶的双重抗氧化作用,DPPH 自由基清除率提升 3.5 倍,细胞内 SOD 活性提升 90%,对氧化应激细胞的保护效应显著增强。
- 蛋白酶体调节与神经退行性疾病的研究 :在阿尔茨海默病小鼠模型中,腹腔注射 Valosin(50 μg/kg),连续给药 30 天,小鼠脑内 Aβ 蛋白沉积量降低65%,蛋白酶体的糜蛋白酶样活性提升 70%,小鼠的学习记忆能力显著改善,证实 Valosin 可通过增强蛋白酶体活性促进 Aβ 蛋白降解,为神经退行性疾病的机制研究提供了新方向。
- 抗炎与血管内皮保护的联用研究:将 Valosin 与低剂量阿司匹林联用,用于 LPS 诱导的大鼠急性血管炎症模型,联用方案可协同下调 TNF-α、IL-6 水平(降低 85%),减少炎症细胞与内皮细胞的黏附(减少 75%),血管内皮的完整性与功能得到显著保护,联用效应优于单一药物,且无明显的胃肠道副作用。
五、相关案例分析
- 蛋白酶体激活与 Aβ 蛋白降解案例 :在体外培养的 SH-SY5Y 阿尔茨海默病细胞模型中,加入 100 nmol/L Valosin,培养 48 小时后,细胞内蛋白酶体糜蛋白酶样活性提升75%,泛素化蛋白水平降低 60%,Aβ1-42 蛋白的沉积量降低 65%;Western blot 结果显示,细胞内 Aβ 降解相关蛋白 NEP 的表达无明显变化,证实 Valosin 通过增强蛋白酶体活性而非上调降解酶实现 Aβ 蛋白降解。
- 肿瘤细胞增殖抑制案例 :在体外培养的 A549 人肺癌细胞中,加入 50 nmol/L、100 nmol/L Valosin,培养 72 小时后,细胞增殖率分别降低40%、75%,流式细胞术检测显示细胞周期阻滞于 G1/S 期,G1 期细胞比例从 45% 升至 78%;Western blot 结果显示,Cyclin D1、c-Myc 蛋白表达水平分别下调 60%、70%,ERK1/2 磷酸化水平降低 80%。
- 抗炎与氧化应激保护案例 :在 LPS+H₂O₂诱导的 RAW264.7 巨噬细胞炎症氧化应激模型中,加入 80 nmol/L Valosin,细胞内 TNF-α、IL-6 的释放量分别降低70%、65%,ROS 水平降低 75%,SOD、GSH-Px 活性分别提升 80%、70%;同时,细胞的凋亡率从 55% 降至 15%,证实 Valosin 兼具抗炎与抗氧化的双重细胞保护作用。
- 体内血管平滑肌细胞增殖抑制案例 :在大鼠球囊损伤后血管再狭窄模型中,局部注射 Valosin(20 μg/kg),术后 14 天,大鼠颈动脉内膜 / 中膜厚度比较生理盐水组降低65%,血管平滑肌细胞增殖率降低 70%;免疫组化结果显示,损伤部位 Cyclin D1 蛋白表达下调 65%,蛋白酶体活性提升 60%,证实 Valosin 通过增强蛋白酶体活性抑制血管平滑肌细胞异常增殖,减轻血管再狭窄。