作者:电控工程手札
本博文内容著作权归作者所有,转载请务必保留本文链接
目录
- [1. 电子层(能层)](#1. 电子层(能层))
- [2. 能级(亚层)](#2. 能级(亚层))
- [3. 轨道](#3. 轨道)
1. 电子层(能层)
在原子的玻尔模型中可以看到,电子在离原子核有一定距离的特定轨道上绕原子核运行。一个轨道为一个电子层。
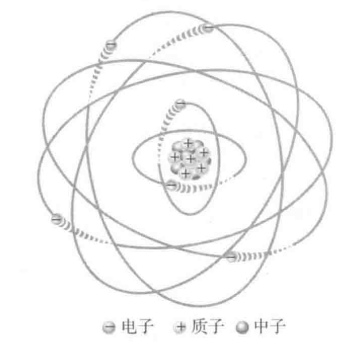
(1)定义
核外电子围绕原子核运动时,由于能量不同,离核的平均距离也不同:能量越低的电子,通常离核越近;能量越高的电子,离核越远。这种按 "能量高低" 和 "离核平均距离" 划分的电子运动区域,称为 电子层 (或能层)。
(2)表示方法
用 主量子数 n 标记,n的取值为正整数(n=1,2,3,4,...),对应电子层符号为 K,L,M,N,O,P,...(n=1 对应 K 层,n=2 对应 L 层,以此类推)。
(3)能量规律
电子层的 能量随 n 增大而升高(即K < L < M < N < ...)。例如:K 层(n=1)电子能量最低,离核最近;N 层(n=4)电子能量更高,离核更远。
(4)容量
2n²
| n | 名称 | 最大电子容量 |
|---|---|---|
| 1 | K层 | 2 |
| 2 | L层 | 8 |
| 3 | M层 | 18 |
| 4 | N层 | 32 |
2. 能级(亚层)
(1)定义
同一电子层(同一n)中,电子的能量并非完全相同,还存在更精细的能量差异,这种差异源于电子运动的 "轨道形状" 不同。因此,同一电子层可进一步划分为若干 能级 (或亚层)。
(2)表示方法
用角量子数 l 标记,l 的取值由 n 决定(l=0,1,2,...,n-1),对应能级符号为s,p,d,f,g,...(l=0对应s,l=1对应p,l=2对应d,l=3 对应 f,以此类推)。
(3)能量规律
-
同一电子层内,不同能级的 能量按s < p < d < f < ...递增(因l越大,能量越高)。例如:n=3(M 层)的能级能量:3s < 3p < 3d。
-
不同电子层的同类型能级,能量随n增大而升高。例如:1s < 2s < 3s < 4s,2p < 3p < 4p。
-
特殊情况(能级交错):当 n 和 l 都不同时,可能出现 "外层低能级能量低于内层高能级" 的现象(如4s < 3d),这是后续电子排布的重要依据。
顺序遵循 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p⋯
(4)容量
每个能级包含的 "原子轨道" 数量固定(轨道是电子运动的空间区域):s能级 1 个轨道,p能级 3 个轨道,d能级 5 个轨道,f能级 7 个轨道(轨道数 = 2l+1)。
3. 轨道
(1)定义
同一能级内空间取向不同的电子云区域为 轨道。它并非宏观世界中 "物体运动的固定路径"(如行星绕太阳的轨道),而是量子力学中描述核外电子运动状态的空间概率分布区域
(2)表示方法
由磁量子数 m 标记,m 的取值由 l 决定(m=-l,...,0,...,+l)
(3)容量
每个轨道容纳2个自旋相反的电子(泡利不相容原理)。泡利原理直接决定了原子中各能级、各电子层能容纳的最多电子数。
| l | 符号 | 轨道形状 | 轨道数 | 电子容量 |
|---|---|---|---|---|
| 0 | s | 球形 | 1 | 2 |
| 1 | p | 哑铃形 | 3 | 6 |
| 2 | d | 花瓣形 | 5 | 10 |
| 3 | f | 复杂形 | 7 | 14 |
纯手工码字,如果你觉得还不错的话,请不要吝啬你的一键三连哟!!!(^U^)ノ~YO