一、能层(电子层)
定义: 在多电子原子中,根据电子离核远近与能量高低划分的层次。
| 电子层序数 (n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| 符号表示 | K | L | M | N | O | P | Q |
| 能量关系 | E₁ < E₂ < E₃ < ... < E₇ (n 越大,能量越高) |
| 距核远近 | 近 → 远 (n 越大,电子平均离核越远) |
二、能级(电子亚层)
定义: 在同一能层内部,电子能量还有细微差别,据此划分出的能量相同的电子亚层。
- 每个能级对应一种形状的原子轨道(s, p, d, f...)。
- 能级符号:
ns、np、nd、nf...(n 为能层序数)。
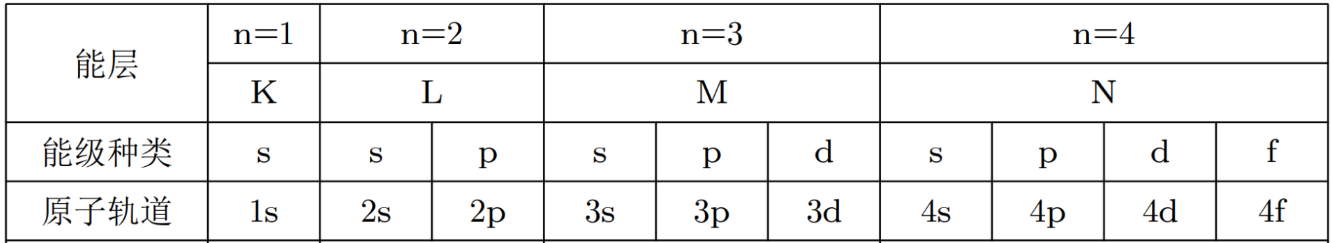
能层与能级的对应关系
在一个能层 n 中,能级的种类数等于 n。
| 能层 (n) | 包含的能级(亚层) | 能级数量 |
|---|---|---|
| n = 1 | 1s | 1个 |
| n = 2 | 2s, 2p | 2个 |
| n = 3 | 3s, 3p, 3d | 3个 |
| n = 4 | 4s, 4p, 4d, 4f | 4个 |
当 n = 1 时,原子轨道数为 1。
当 n = 2 时,原子轨道数为 1+3=4。
当 n = 3 时,原子轨道数为 1+3+5=9。
当 n = 4 时,原子轨道数为 1+3+5+7=16。
所以对于第 n 层,其能级个数为 n,其原子轨道数(空间运动状态)为 n^2 ,最多可容纳 2*(n^2 ) 个电子。
三、原子轨道数量与电子容量计算公式
每个能级由一个或多个原子轨道(空间运动状态)组成。
| 能级符号 | 轨道数量 | 容纳电子数 |
|---|---|---|
| s | 1 (个轨道) | 2 (电子) |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
通用公式:
- 一个能级中的轨道数 =
2 × (角量子数 l) + 1
(其中 s: l=0, p: l=1, d: l=2, f: l=3) - 每个轨道 最多容纳 2 个自旋相反的电子。
四、第 n 能层的总量归纳
对于第 n 电子层:
| 项目 | 计算公式 | 例子 (n=3) |
|---|---|---|
| 包含的能级数 | n 个 | 3个 (3s, 3p, 3d) |
| 原子轨道总数 | n² 个 | 3² = 9个轨道 |
| 最多容纳电子数 | 2n² 个 | 2 × 3² = 18个电子 |
推导过程:
- 第 n 层有能级:s(1轨道), p(3轨道), d(5轨道)... 直到 l = n-1 的能级。
- 轨道总数 = 1 + 3 + 5 + ... + (2n - 1) = n² (奇数序列求和公式)。
- 电子总数 = 轨道数 × 2 = 2n²。
五、记忆与理解要点
-
能层是"楼层",能级是"户型":
- 楼层越高(n越大),能量越高,离核越远。
- 同一楼层有不同户型(s, p, d, f),其能量与形状不同。
-
能量交错现象(重要!) :
实际电子填充顺序不完全按能层高低,而是遵循 能级交错顺序 :
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p ...

(口诀:按构造原理图对角线顺序填充)
-
电子容量公式
2n²是理论最大值,实际原子在基态时,电子按上述能量顺序填充,不会在所有高层轨道都填满。
通过这个系统,可以从 能层(n) → 能级类型 → 轨道数量 → 电子容量 逐步推导,完整理解原子核外电子的排布结构。
六、电子云与轨道
原子轨道 的图形化表示,它描述了电子在空间中可能出现的概率区域 。
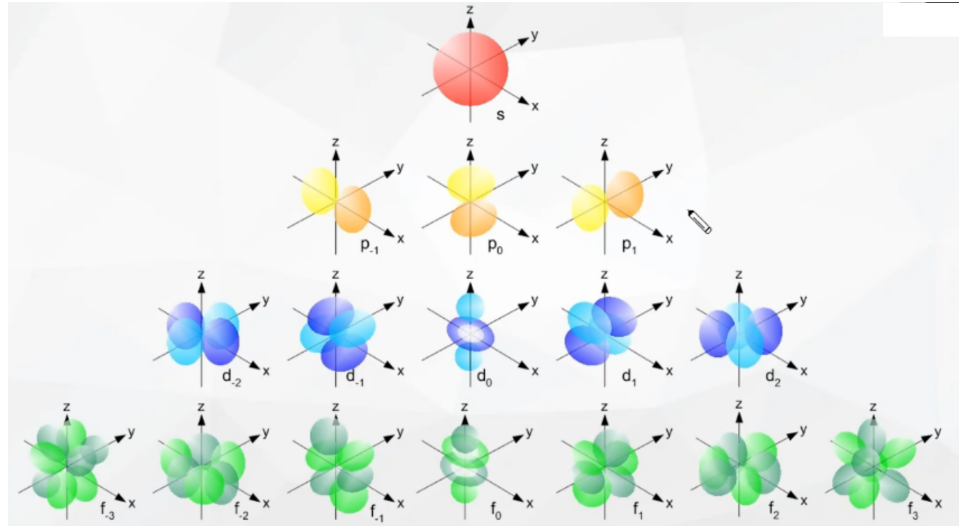
形状图描绘的是电子出现概率高达90%以上的空间区域 ,不是电子固定的运行轨道,更像一团"概率云"。图中的"瓣"或"叶"是概率区域,正负号(+/-)代表波函数的相位,在成键时至关重要(同相加成,异相相消)。
| 特征 | 轨道数量 | 形状描述 | 空间取向 | 最大电子容量 | 首次出现的主能层 | 主要关联元素 | 成键中的主要角色 | 成键中的主要角色 |
|---|---|---|---|---|---|---|---|---|
| s 轨道 | 1个 (每层) | 球形 | 无方向性 (球形对称) | 2个 | 第1层 (n=1) | 所有元素 | 形成σ键的基础,杂化轨道的组成部分 |  |
| p 轨道 | 3个 (px, py, pz) | 哑铃形 (沿轴方向) | 相互垂直 (沿x, y, z轴) | 6个 (2×3) | 第2层 (n=2) | 第二周期及以后的主族元素 (如C, N, O) | 形成σ键 和π键 ,决定分子几何构型 | 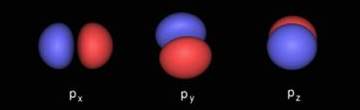 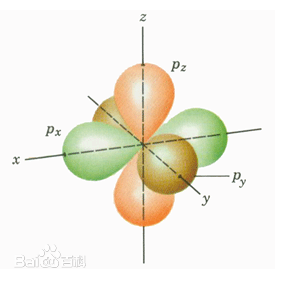 |
| d 轨道 | 5个 (如dxy, dz²) | 四叶草形 (4个) / 哑铃加环状 (1个) | 沿坐标轴或对角方向 | 10个 (2×5) | 第3层 (n=3) | 过渡金属元素 (如Fe, Cu) | 形成配位键 ,决定配合物结构、颜色与磁性 | 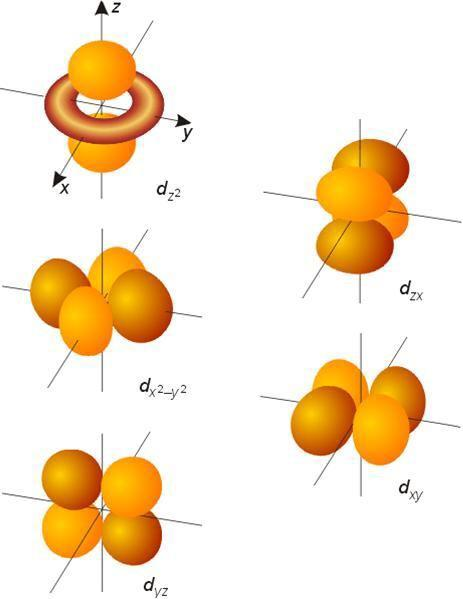 |
| f 轨道 | 7个 | 复杂多瓣形 | 高度复杂,多种取向 | 14个 (2×7) | 第4层 (n=4) | 内过渡金属元素 (镧系、锕系) | 贡献特殊磁性、光学性质,对键影响次要 | 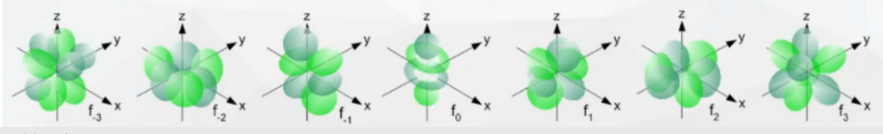 |
1. s 轨道 - 球形套房
- 形状 :完美的球形。像洋葱的壳层,或一个毛线球。
- 特点 :
- 球形对称:无论从哪个方向看都一样。
- 没有方向性:s电子在原子核周围均匀分布。
- 每层只有一个:每个能层(1,2,3...)有且仅有一个s轨道(1s, 2s, 3s...)。
- 2s、3s轨道也是球形,但半径更大,内部可能包含概率为零的"节面"(像洋葱的层与层之间)。
形象比喻:原子核是球心,s电子像一层均匀的球形雾包裹着它。
2. p 轨道 - 哑铃型双人间(三套)
- 形状 :两个相切的球体("哑铃"或"数字8"形),在原子核处相连(该点概率为零,称为"节点")。
- 特点 :
- 强方向性 :三个p轨道在空间上相互垂直,沿直角坐标轴的x、y、z方向伸展。
- 三个等价轨道 :分别称为 px、py、pz。它们形状相同,只是空间取向不同。
- 每个哑铃的两瓣相位相反 (通常标记为
+和-)。
形象比喻:原子核位于哑铃的握柄中心。px轨道是东西走向的哑铃,py是南北走向,pz是上下走向。它们构成了原子成键的"三维触手"。
3. d 轨道 - 四叶草与哑铃复合型(五套)
形状更复杂,有五种取向,主要分为两类:
- 第一类(4个):四叶草形
- dxy、dxz、dyz轨道:叶片位于坐标轴之间的平面上,形状像四片花瓣。
- dx²-y²轨道:叶片直接指向x轴和y轴,也是四叶形,但取向不同。
- 第二类(1个):哑铃加面包圈形
- dz²轨道:形状独特,像沿着z轴的哑铃,腰部多了一个环状(炸面圈形)区域。
特点:
- 方向性极强,能量比s、p轨道高。
- 在过渡金属化学中至关重要,决定了配位化合物的几何结构和颜色。
形象比喻:d轨道是原子的"高级多功能接口",为形成复杂的化学键和配位结构提供了空间基础。
4. f 轨道 - 复杂花瓣型(七套)
形状极其复杂,有七种不同的空间取向,像多重花瓣或更抽象的几何组合。
- 特点 :
- 能量最高,出现在镧系和锕系元素中。
- 形状难以用简单语言描述,通常涉及多个瓣和节点。
- 它们的存在使得稀土元素具有独特的光学和磁性。
形象比喻:f轨道是原子的"终极特种装备",专用于最重元素的特殊化学反应和物理性质。
理解形状的意义:化学键的根源
知道这些形状不是纸上谈兵,它能直接解释化学键如何形成:
- σ键(头对头重叠):s-s、s-pz、pz-pz等沿键轴方向重叠形成。电子云密度集中在两核连线处。例如,H₂分子中两个1s轨道的重叠。
- π键(肩并肩重叠):px-px、py-py在侧面平行重叠形成。电子云密度分布在键轴上下或两侧。例如,乙烯(C₂H₄)中两个碳原子的p轨道侧向重叠形成π键。
- 杂化轨道:原子在成键前,会"混合"不同形状的轨道,形成新的、具有特定方向性的轨道(如sp³四面体、sp²平面三角形、sp直线形)。这完美解释了甲烷(CH₄)的正四面体结构、乙烯的平面结构等。
总结一下:
- s轨道(球):是基础,提供非方向性的成键能力。
- p轨道(哑铃):提供了在x,y,z三个垂直方向成键的能力,是构建大部分有机分子骨架的关键。
- d轨道(四叶草/复合):为过渡金属引入配位化学、颜色和催化性能。
- f轨道(复杂花瓣):决定了稀土和锕系元素的独特性质。
所以,这些形状图就是原子在三维空间中伸出"化学双手"的蓝图。理解它们,你就能在脑海中"看到"分子是如何通过轨道重叠原子连接在一起的。这就是结构化学的视觉语言!