作者,Evil Genius
新生人口792万,人口负增长339万,GDP增长了5%,按照这个推理,每个人平均收入应该增长了5.1%,我呢是负的70%,谁把我平均了能告诉我一声么?😄
我决定这几天回老家反省一下。
今天我们分享文献,总结一下其中的知识

组织内部具有特定细胞组成和相互作用模式的重复性结构------细胞邻域概念,深刻改变了人们对肿瘤生态系统复杂性与动态性的理解。
细胞邻域作为组织中反复出现的空间结构,已成为驱动肿瘤微环境内复杂动态过程(如肿瘤生长、进展、免疫逃逸和转移)的基本功能单元。
细胞邻域的定义
现有文献对细胞邻域的概念定义主要分为三类:(1) 固定空间窗口内重复出现的细胞类型组合模式;(2) 大型组织学结构或解剖学分区(如肿瘤核心区与免疫浸润区);(3) 具有独特空间基因表达程序与细胞间通讯模式的组织区域。
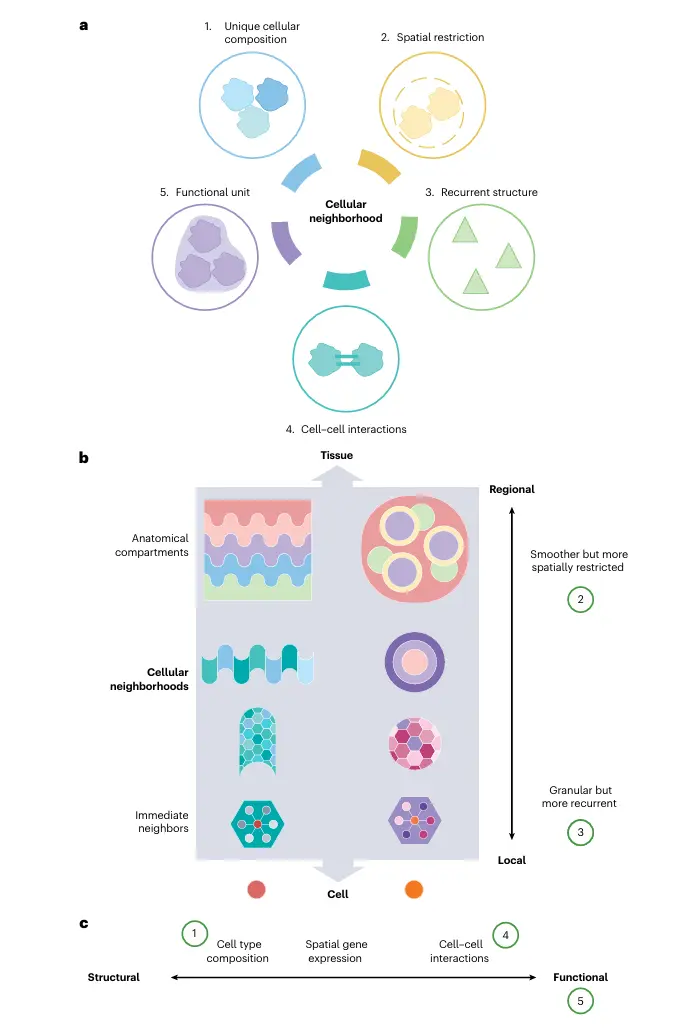
所有细胞邻域均具备五个核心特征:(1) 独特且典型的细胞组成;(2) 组织内的空间局限性;(3) 跨组织区域或样本的可重复性;(4) 细胞间相互作用的富集;(5) 作为组织内功能单元的作用
空间尺度的关键性差异
现有定义的核心分歧在于空间尺度:在局部尺度上,细胞邻域可指单个细胞的直接微环境;在区域尺度上,则指具有特定细胞类型组成或基因表达模式的更大空间连续区域。值得注意的是,同一组织中可能并存多级空间尺度。多数检测方法通过调节分辨率参数来适应不同尺度需求。
计算方法的多维聚焦
不同计算方法在生物特征侧重上存在差异,沿着"结构-功能"光谱捕捉细胞邻域的不同维度:有的侧重特征性细胞组成,有的关注空间表达模式,还有的聚焦细胞间相互作用网络。这种多维视角共同推进了对组织空间架构的系统解析。
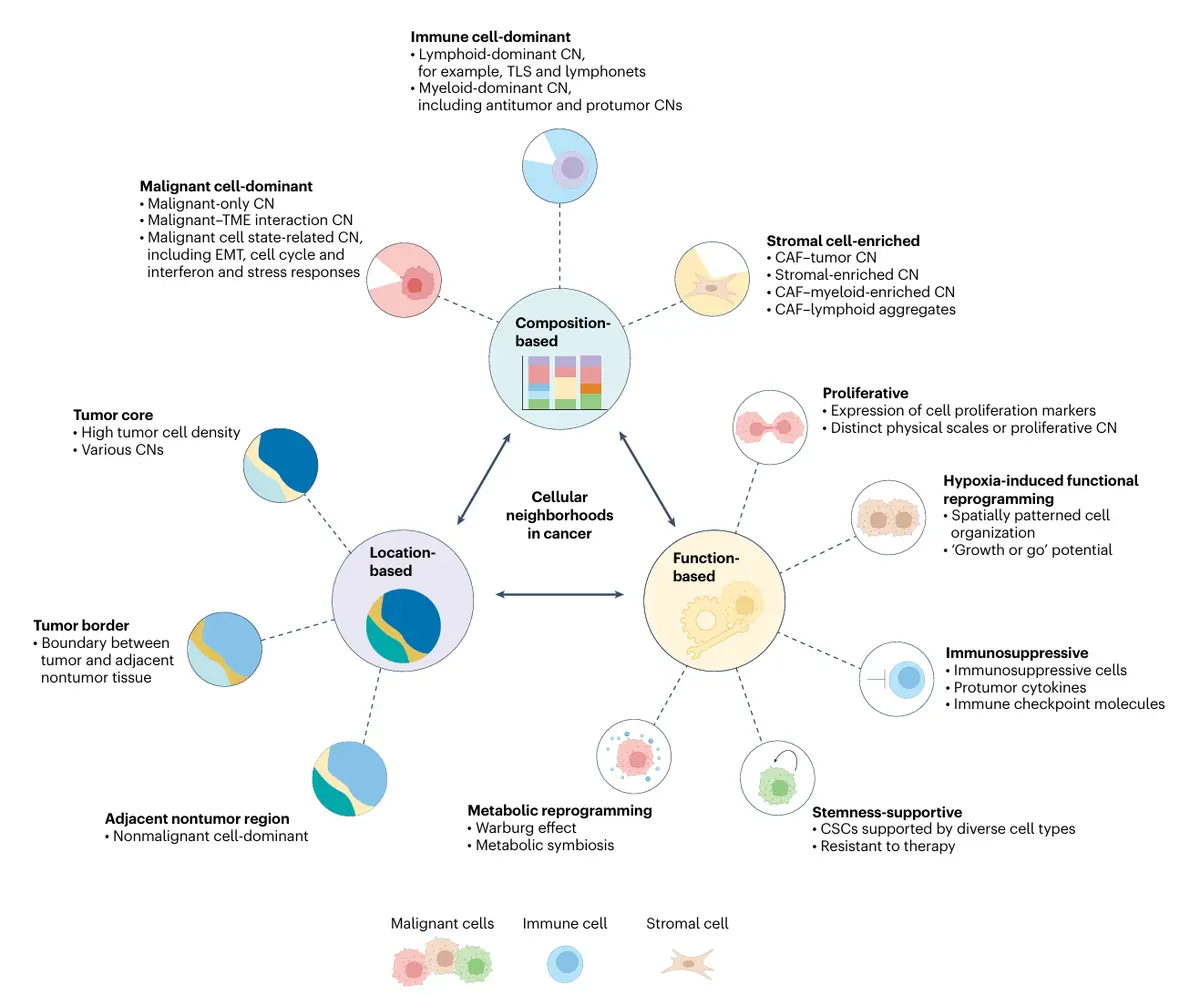
癌症细胞邻域的分类体系
基于细胞组成的分类
这是细胞邻域分类的基础性方法,通过人工注释或统计分析依据主导细胞类型进行定义。其虽直观且可扩展,但在确立"主导性"的普适阈值方面面临挑战------该阈值可能随肿瘤类型、组织背景和空间尺度变化。此类分类仍为定义关键细胞邻域类别、绘制肿瘤空间组织图谱提供了有效框架。
恶性细胞主导型邻域:构成肿瘤的主要结构和功能组分,可分为两类:
纯恶性细胞邻域:免疫活性低的密集肿瘤区域。
恶性-TME交互型邻域:以恶性细胞与免疫细胞、成纤维细胞、内皮细胞等TME组分的相互作用为特征,常参与免疫应答、基质重塑或血管生成活动,在肿瘤进展和免疫逃逸中起重要作用。
此外,恶性细胞的不同状态(如上皮-间质转化、细胞周期、干扰素应答、缺氧与应激反应)常与特定微环境共定位,形成恶性细胞状态相关邻域亚型。例如,在肝癌、肺癌、卵巢癌等癌症中已发现与独特TME组成或免疫细胞共定位相关的特定状态邻域。
免疫细胞主导型邻域:按主要免疫细胞谱系分为两类:
淋巴系主导型邻域:主要由协调适应性免疫应答的T细胞和B细胞构成。典型例子是三级淋巴结构(TLS)。近期研究还发现了其他类型,如肺腺癌中的"淋巴网"以及B细胞主导型邻域。
髓系主导型邻域:以巨噬细胞、单核细胞、树突状细胞、粒细胞等高丰度为特征。其细胞亚型和功能状态多样,导致形成一系列组成和功能各异的髓系邻域。例如,脑瘤和胰腺癌中某些M1样或基质相关巨噬细胞富集邻域与抗肿瘤免疫相关,而肝癌中某些巨噬细胞/中性粒细胞富集邻域则具有免疫抑制功能。
基质细胞富集型邻域:以丰富的成纤维细胞和内皮细胞为特征,是TME的关键调节者。已鉴定出四种主要的癌症相关成纤维细胞(CAF)富集邻域亚型(CAF-肿瘤型、基质富集型、CAF-髓系富集型、CAF-淋巴聚集型),各具独特组成、空间背景和分子特征,并通过特定配体-受体相互作用网络(如FGF、TGFB、胶原蛋白信号)发挥功能。
基于功能的分类
尽管许多细胞邻域的功能尚不明确,近期空间组学研究已识别出具有特定生物活性的邻域。我们重点介绍在肿瘤生长增殖、组织重塑与重编程以及免疫调节中起关键作用的几类。
增殖性细胞邻域:增殖细胞并非随机分布,而是组织成独特的增殖性邻域。在PDAC中,Ki-67+和Ki-67−细胞形成不同邻域。邻域大小可能反映局部克隆扩增或宏观环境因素。
缺氧诱导的功能重编程邻域:缺氧是大多数实体瘤的常见特征。在胶质母细胞瘤等癌症中,缺氧驱动形成具有分层组织的细胞邻域,各层具有不同的肿瘤细胞状态和免疫-基质相互作用。缺氧调控肿瘤细胞的"生长或迁移"潜力,诱导代谢转变、细胞周期停滞和基因组不稳定性,形成缺氧相关代谢与细胞迁移之间的反向轨迹。
免疫抑制性细胞邻域:通过多种细胞类型的复杂相互作用形成,调节性T细胞和M2型巨噬细胞等在协调其免疫抑制动态中起核心作用。典型的免疫抑制邻域是肿瘤边界,其致密的促结缔组织增生基质构成物理屏障,且细胞因子/趋化因子募集免疫抑制细胞,并表达免疫检查点分子,共同支持肿瘤生长和免疫逃逸。
干细胞支持性细胞邻域:为癌症干细胞(CSC)提供支持性微环境。在胶质母细胞瘤、急性髓系白血病等癌症中,已发现分化恶性细胞、CAF、肿瘤相关巨噬细胞等通过旁分泌信号(如BDNF-NTRK2)或细胞因子(如IL-6、IL-8)与CSC共定位并支持其生存。
代谢重编程细胞邻域:肿瘤细胞不仅普遍存在有氧糖酵解(瓦伯格效应),还依赖与邻近细胞的代谢互作。例如,在富氧区域,恶性细胞常利用邻近糖酵解细胞产生的乳酸作为主要能量来源,形成代谢共生。空间组学研究揭示了糖酵解活性降低但谷氨酰胺摄取增加的恶性细胞富集邻域。代谢共生也延伸至基质细胞和免疫细胞(反向瓦伯格效应)。
基于空间位置的分类
按在肿瘤及周围组织中的位置,细胞邻域可分为:肿瘤核心区、肿瘤边界区和邻近非恶性区域。每个区域代表解剖学上独特且具有特定细胞分子特征的区室。
组成偏好:某些类型邻域倾向于定位于特定区室。例如,纯恶性细胞邻域主要在肿瘤核心,而恶性-TME交互型邻域在核心和边界均存在。免疫细胞主导型和基质细胞富集型邻域则可见于多个区室。
功能与位置关联:细胞邻域的空间位置常与其功能相关。缺氧相关功能重编程邻域多位于缺氧最显著的肿瘤核心。免疫抑制性邻域在核心和边界均存在,其免疫抑制环境常与SPP1+巨噬细胞和成纤维细胞的共定位相关。
位置影响功能:细胞邻域的功能可能因其位置而有显著差异。例如,肿瘤内的三级淋巴结构(TLS)通常与抗肿瘤免疫相关,但在肝内胆管癌中,瘤内和瘤周TLS却与不同的临床结局相关。需注意"肿瘤边界"与"肿瘤侵袭前沿"在概念上的空间区别
细胞邻域识别与比较的计算方法
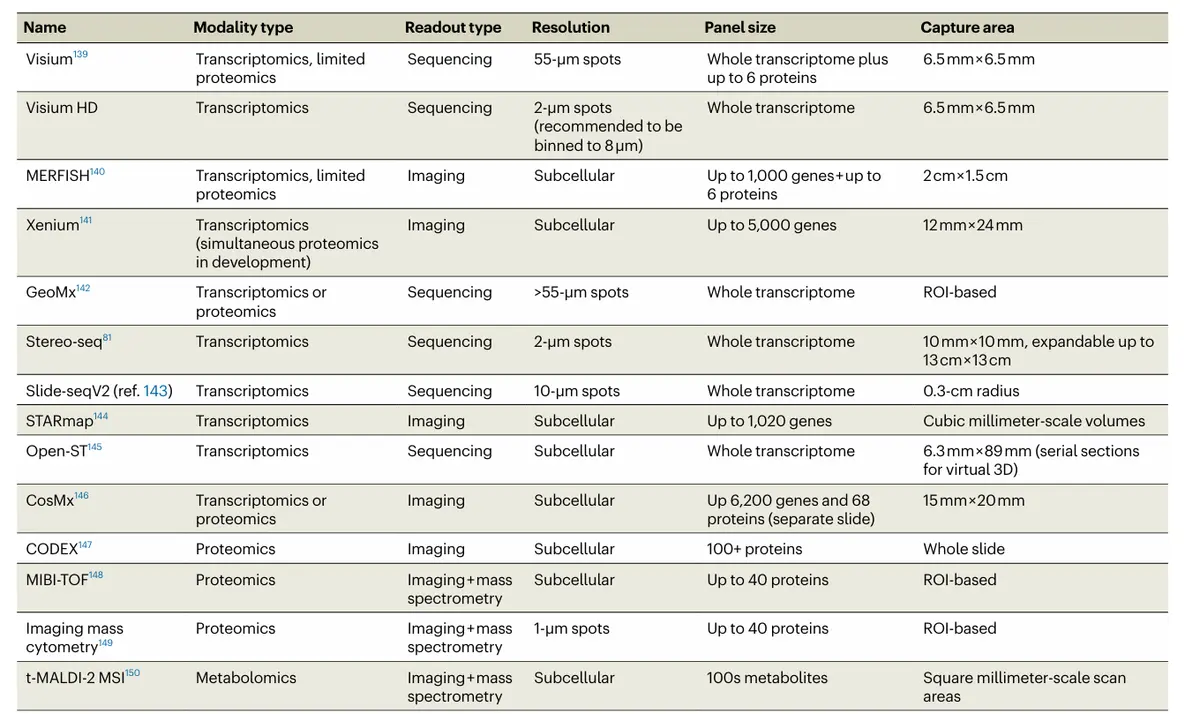
表征肿瘤微环境(TME)空间特征的技术,主要分为两类:
成像技术:如CODEX(靶向蛋白质组)、CosMx(单细胞全转录组)和Xenium,可达到细胞级分辨率。
测序技术:如10x Visium(点分辨率全转录组)和Stereo-seq。
不同平台在分子覆盖度(靶向/全转录组)与分辨率(细胞/点水平)上各有侧重。
计算方法的核心策略
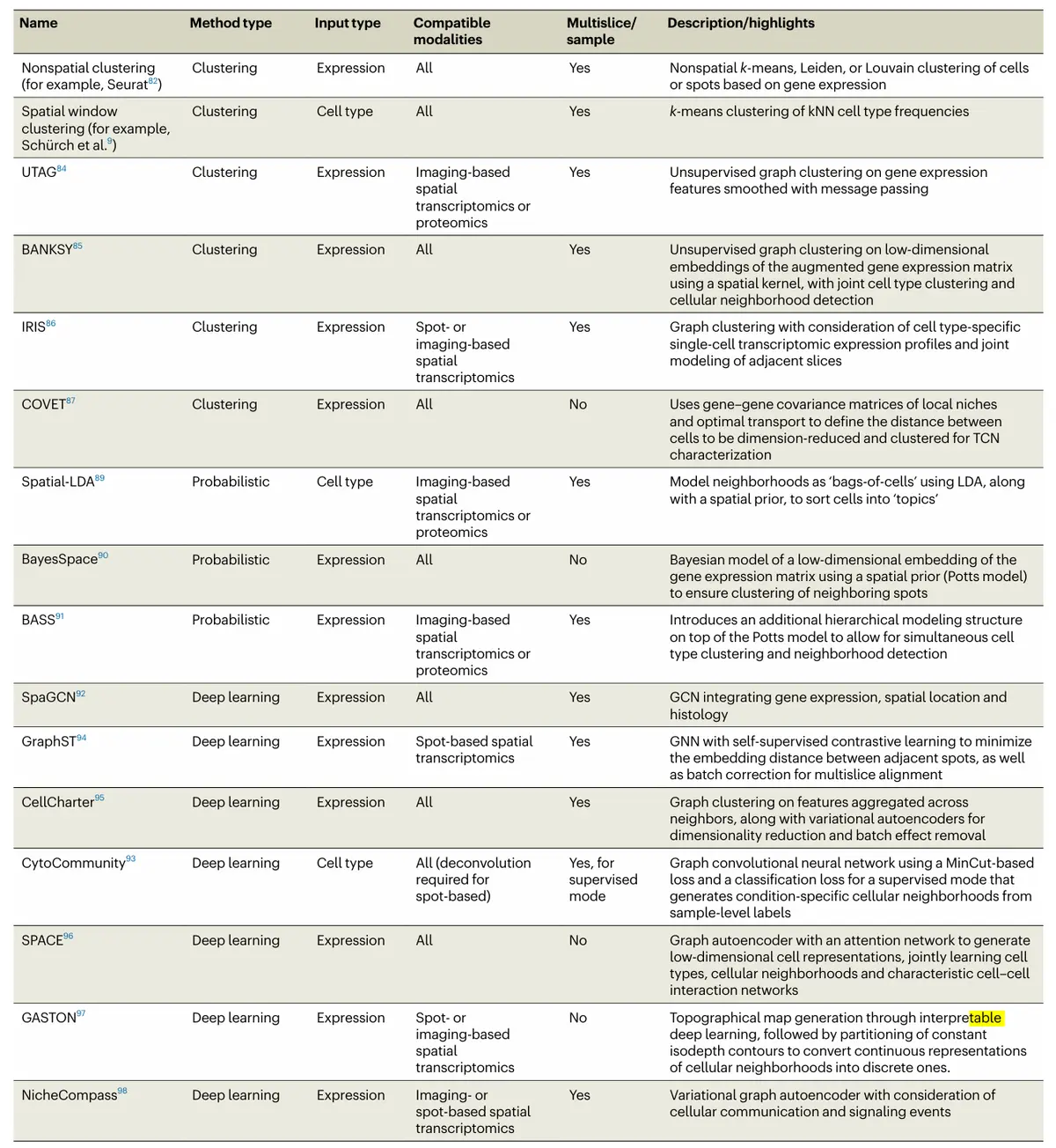
细胞邻域的不同概念定义直接影响计算策略的选择,包括输入数据类型(细胞类型 vs. 基因/蛋白表达)、分析尺度、空间先验的融入以及所包含的生物信号类型。主要方法可分为以下几类:
基于聚类的方法(最常用):
非空间聚类:类似单细胞分析,对降维后数据或图嵌入(如Seurat的Louvain聚类)进行聚类,忽略空间信息。
空间聚类:在聚类中明确纳入物理邻近性。经典方法基于细胞在局部邻域内的细胞类型频率进行k-means聚类。该方法因简单易用而被广泛采用。
空间增强聚类:在聚类前通过"信息传递"(如UTAG)、添加局部邻域平均表达与梯度(如BANKSY)、或结合单细胞参考推断细胞类型(如IRIS)等方式,对表达矩阵或图节点特征进行空间平滑或增强,以更好地捕获空间背景。
基于概率模型的方法:
主题模型类:如Spatial-LDA,将邻域视为"细胞袋",并加入空间先验以促进空间连贯性。
贝叶斯混合模型类:如BayesSpace,在聚类基因表达低维嵌入时,使用基于Potts模型的空间先验促进相邻点的空间连续性。BASS在此基础上进行层次化扩展,可同时推断细胞类型与细胞邻域。
基于深度学习的方法:
常采用图神经网络(GNN)架构。例如SpaGCN应用图卷积网络(GCN),CytoCommunity使用带MinCut损失函数的GCN框架以平滑邻域边界(并提供有监督模式识别条件特异性邻域)。
新方法增加了批次校正(如GraphST、CellCharter)、联合细胞类型聚类(如SPACE)、或连续梯度分析(如GASTON)等功能。
新兴方法开始显式整合细胞间信号信息,如NicheCompass利用配体-受体互作先验知识指导空间基因程序学习。
方法性能评估
一项基准研究评估了19种方法在真实与合成空间转录组数据上的表现,聚焦准确性、稳定性、通用性和可扩展性四个指标。主要发现:
空间信息显著提升识别准确性。
无单一方法在所有数据模态上全面领先。多数方法在10x Visium数据上表现最佳,但在STARmap和Slide-seqV2上较差,可能源于平台数据特性差异及算法偏差。
综合考虑,GraphST、BayesSpace、SpaGCN和STAGATE是最有效且稳健的方法。其中GraphST在聚类准确性、计算效率和内存使用上取得了最佳平衡,被推荐为首选工具。
集成多种方法的结果常能增强鲁棒性,尤其对于挑战性数据集。
参数调优很重要,基于GCN的工具默认参数并非总是最优。
细胞邻域比较方法
目前缺乏直接比较不同生物条件(如治疗反应、疾病进展)下细胞邻域变化的标准化策略。多数研究依赖间接评估(如邻域内细胞类型的差异富集),这要求检测方法支持多切片/多样本的邻域标签对齐。
近期方法如COVET 和NicheCompass提供了映射单个细胞周围局部生态位的策略,后者还能将查询细胞映射到预定义的生态位空间。
基于窗口的邻域检测方法已被扩展用于可视化特定细胞类型(如T细胞)的局部生态位。
在捕获高阶空间结构或复现性组织模式方面,SMORE 等空间模体发现工具提供了独立于邻域检测的补充分析。
未来方向:开发用于细胞邻域比较与对齐的计算方法至关重要,将有助于绘制TME的时空动态轨迹,并揭示不同患者亚型或临床结局间肿瘤空间结构的差异。