作者,Evil Genius
对不起了,朋友们,尽力了,春晚我的节目还是取消了,实在是干不过沈腾马丽。
今天我们分享文献,看看空间TCR的分析。
知识积累
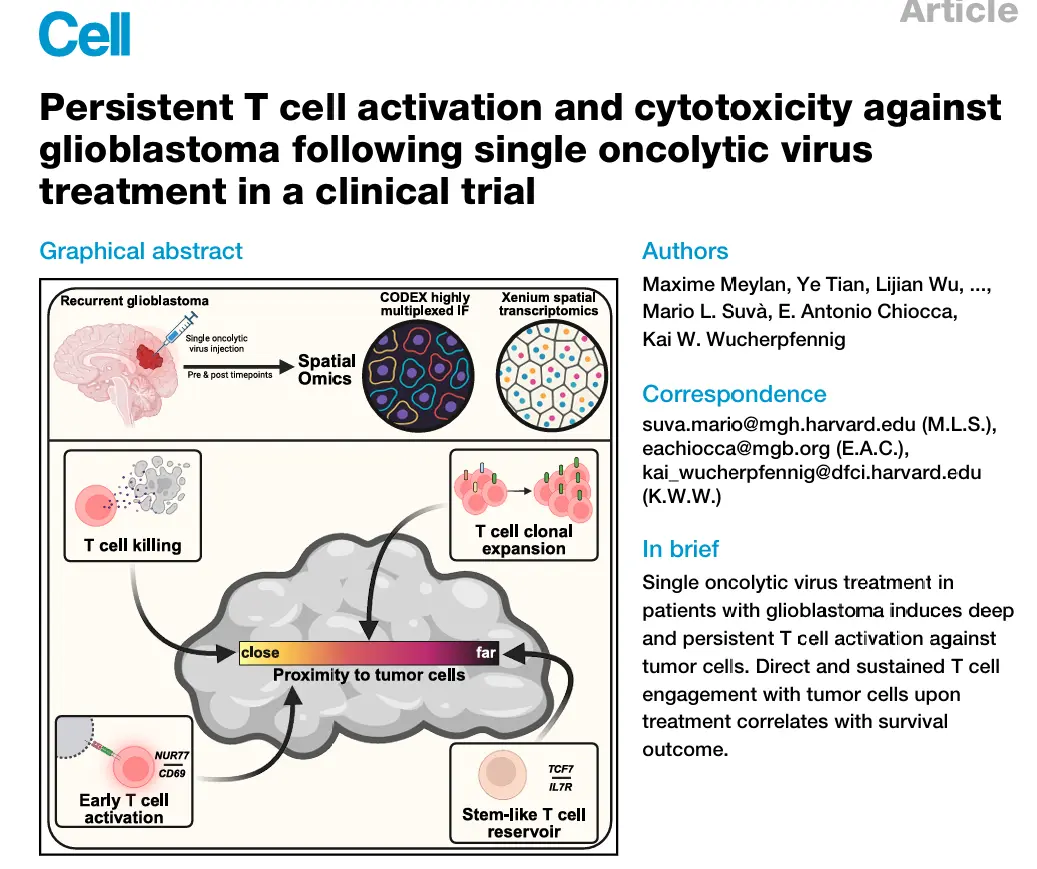
在近期发表的复发性GBM首次人体临床试验(NCT03152318 A组)。
评估了rQNestin34.5v.2(CAN-3110,linoserpaturev)------一种将病毒ICP34.5基因置于巢蛋白启动子(GBM过表达基因)调控下的oHSV-1。治疗后切除标本显示T细胞浸润增加,基于T细胞受体β链的T细胞占比与生存期的相关性独立于HSV-1血清学状态。
结果1、单次溶瘤病毒注射后深度、持久的T细胞浸润
CODEX + Xenium。
27种标志物的CODEX检测体系。
在380基因免疫肿瘤学核心panel基础上,补充100条定制探针靶向:(1)T细胞早期活化标志物(含NR4A1、CD69);(2)治疗前/后样本中鉴定的50种扩增TCR克隆型;(3)GBM恶性细胞状态标志;(4)HSV关键基因(ICP4、ICP22、ICP27、ICP34.5、gC)。
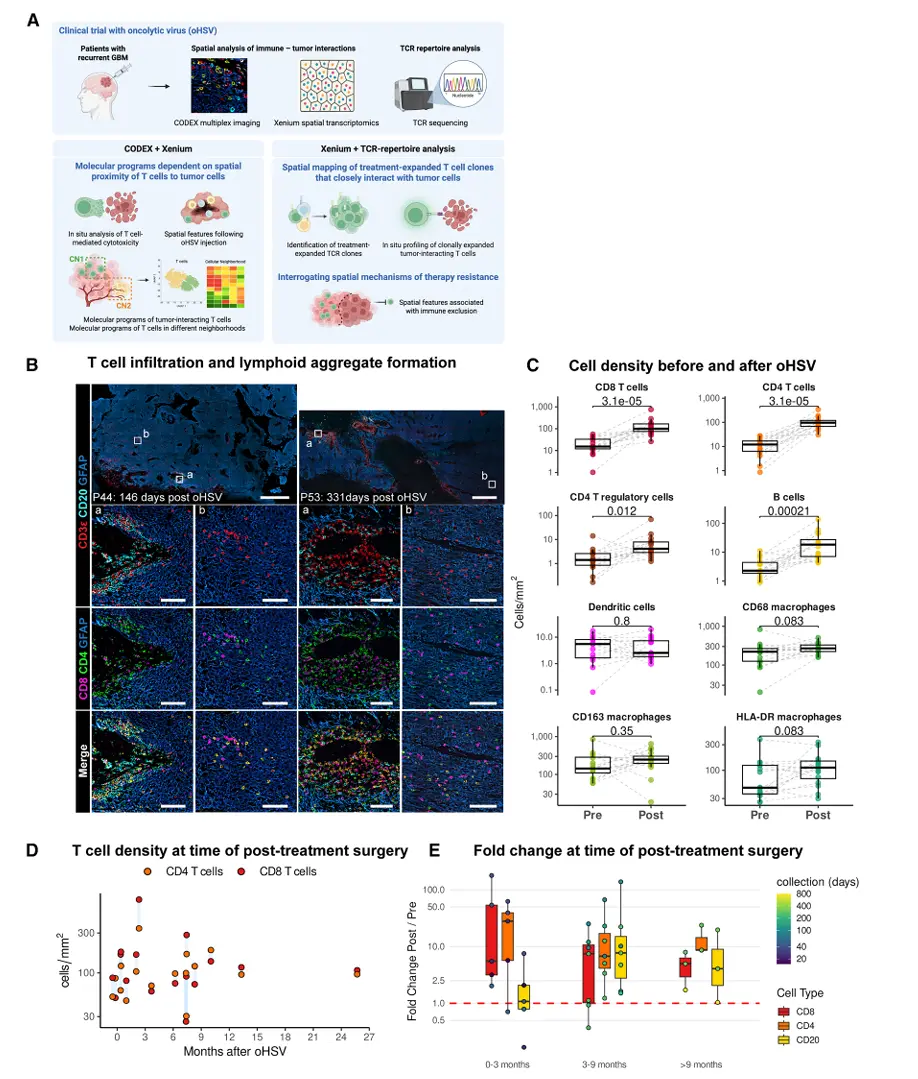
结果2、T细胞介导的GBM细胞毒性作用的原位空间证据
通过空间蛋白质组学(CODEX)与空间转录组学(Xenium)技术,系统揭示了单次oHSV注射后T细胞介导的抗胶质母细胞瘤免疫应答的时空动态特征。
深度、持久的T细胞浸润
治疗后长达2年仍可检测到显著的CD4⁺和CD8⁺ T细胞浸润,部分区域形成淋巴样聚集体,T细胞可深入肿瘤实质。
浸润程度呈现区域异质性,部分亚区高密度浸润,部分稀疏;整体T细胞密度较治疗前显著升高,CD8/Treg比值明显提升。
T细胞介导的细胞毒性作用
原位观察到GZMB⁺ T细胞与凋亡的cl-Casp3⁺肿瘤细胞紧密相邻,提示存在活跃的T细胞杀伤。
GZMB高表达CD8⁺/CD4⁺ T细胞密度与cl-Casp3高表达肿瘤细胞密度呈正相关,而GZMB低表达CD8⁺ T细胞与之呈负相关。
空间梯度与功能表型分化
邻近肿瘤细胞的T细胞高表达GZMB、PD-1、CD44,呈现抗原经历的细胞毒性表型。
距离肿瘤较远的T细胞(如淋巴微环境中)高表达Ki67及CD25,提示为增殖活跃的早期活化或调节性T细胞。
肿瘤细胞对T细胞邻近性的适应性改变
与GZMB中-高表达T细胞近距离接触的肿瘤细胞高表达cl-Casp3、MHC-I、CLEC2D,呈现凋亡、免疫原性及免疫逃逸双重特征。
远距离肿瘤细胞则高表达缺氧标志CA9,MHC-I表达显著下调。
MHC-I与CA9表达在距T细胞约85 μm处出现交叉,提示该距离为T细胞效应与肿瘤免疫重塑的关键阈值。
空间指标与临床预后相关
GZMB中-高表达T细胞与肿瘤细胞的中位距离越短,患者无进展生存期越长,肿瘤生长速率越低。
该空间邻近性可作为T细胞功能有效性与临床获益的组织学指标。
结论:单次oHSV治疗可在GBM中诱导长期、深度的T细胞浸润,并维持持续的细胞毒性活性。空间转录组学进一步揭示了T细胞与肿瘤细胞相互作用的分子梯度与功能异质性,为理解溶瘤病毒诱导的适应性免疫应答及优化联合治疗策略提供了机制依据。
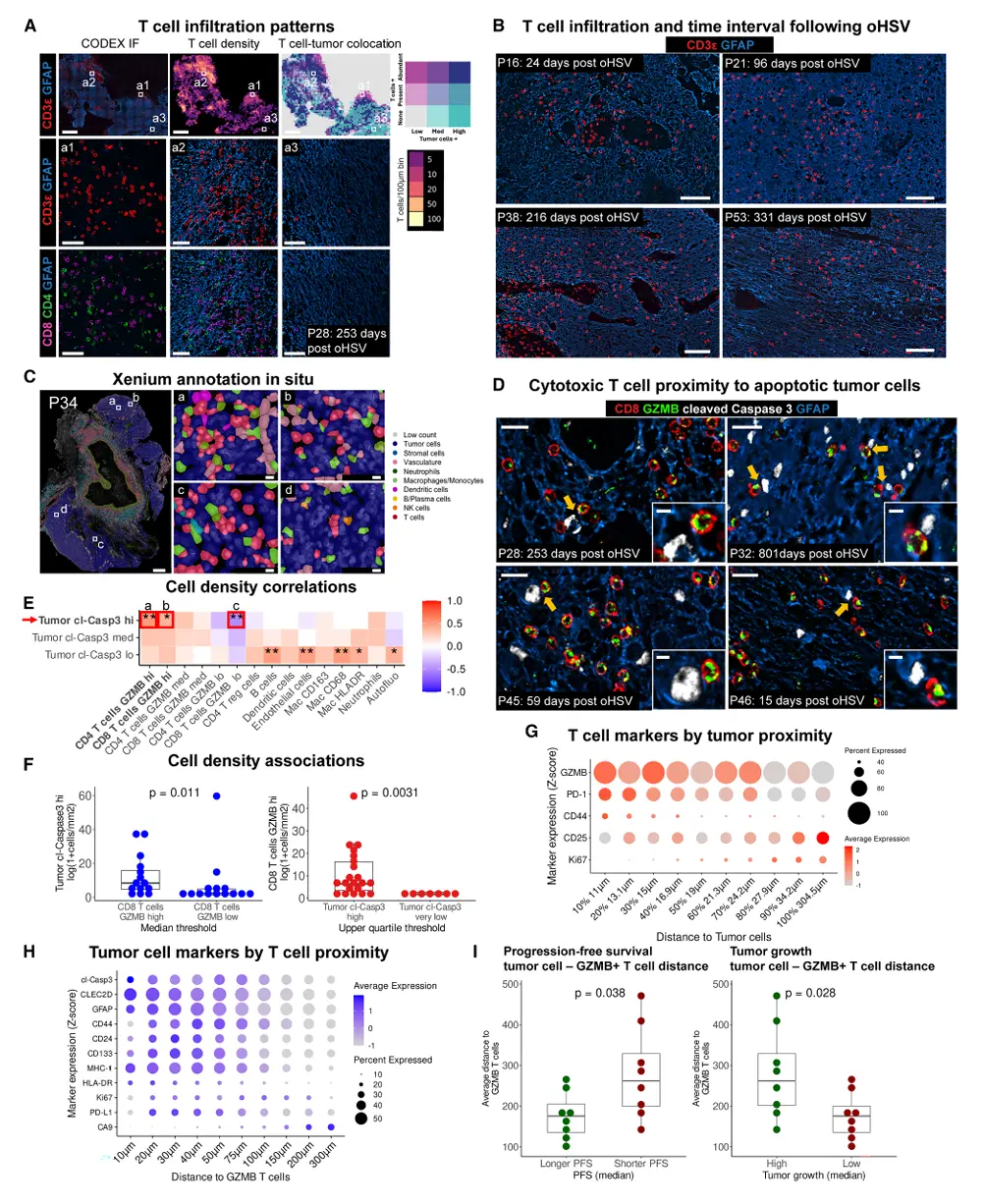
结果3、T细胞早期活化与组织驻留程序的空间分子证据
通过Xenium空间转录组学进一步解析oHSV治疗后T细胞的功能状态及其空间分布特征。
T细胞功能亚群与治疗扩增
无监督聚类识别出8个CD8⁺和2个CD4⁺ T细胞功能状态,涵盖早期活化(NR4A1⁺/CD69⁺)、组织驻留(ITGAE⁺/ZNF683⁺)、细胞毒性(GZMB⁺/PRF1⁺)、干细胞样(TCF7⁺/IL7R⁺)、增殖(MKI67⁺)、干扰素应答及耗竭等分子程序。
治疗后所有T细胞亚群均显著扩增,其中CD8⁺组织驻留T细胞增幅最大(平均log2FC=3.03),其次为CD8⁺干细胞样T细胞(2.87)和CD4⁺调节性T细胞(2.46)。
T细胞-肿瘤空间梯度与功能极化
肿瘤邻近区域(距肿瘤细胞<35.4 μm)的T细胞显著富集早期活化(NR4A1、CD69、IFNG、TNF)和组织驻留(ITGAE、ZNF683、CXCR6)特征,并高表达细胞毒性分子(GZMB、PRF1)及趋化因子(CCL4、CCL5)及其受体(CCR5、CCR1),提示局部存在持续的TCR激活与T细胞招募。
相反,距肿瘤较远的T细胞高表达干细胞样标志物(TCF7、IL7R、SELL),呈现静息/储备状态。
空间统计分析证实:IFNG⁺、NR4A1⁺ T细胞平均距肿瘤细胞更近2.8--7.8 μm,而IL7R⁺、TCF7⁺ T细胞则远27.4--25.1 μm(p < 0.001)。
原位证据支持持续的肿瘤抗原识别
肿瘤区域内可观察到共表达NR4A1与CD69的T细胞紧密接触肿瘤细胞,提示TCR信号通路持续活化。
组织驻留T细胞(CD103⁺/HOBIT⁺)深度嵌入肿瘤实质,与干细胞样T细胞形成空间"近--远"两极分布格局。
结论:oHSV治疗后,T细胞在GBM微环境中呈现功能极化分布------肿瘤邻近区域富集抗原经历性、早期活化的组织驻留T细胞,具备细胞毒性潜能并驱动局部趋化网络;而远处区域则以干细胞样T细胞为主。这一空间功能梯度为溶瘤病毒诱导的持续抗肿瘤T细胞应答提供了直接的分子原位证据。
结果4、oHSV治疗后T细胞应答的空间区室化特征
通过空间邻域分析揭示了oHSV治疗后肿瘤免疫微环境的高度结构化组织:
多谱系免疫浸润与T细胞空间极化
治疗后浆细胞富集最显著(log2FC=3.47),其次为T细胞(2.91)和树突状细胞(1.46)。
CD8⁺ T细胞呈现明确的空间极化:组织驻留型与早期活化型富集于肿瘤邻近区域(0--15 μm),较远处区域(140--5,369 μm)富集程度高5倍以上;而干细胞样CD8⁺ T细胞在肿瘤近端显著缺失(1.75倍减少)。
八种功能微环境邻域的鉴定
共识别出14个细胞邻域,合并为8个功能区域:肿瘤区、肿瘤-T细胞界面、浆细胞区、淋巴聚集体、血管区、坏死旁区、坏死区。
约40%的T细胞定位于肿瘤-T细胞界面,30%在肿瘤区,16%在淋巴聚集体。
淋巴聚集体:干细胞样T细胞的生态位
淋巴聚集体中35%的T细胞为CD8⁺干细胞样T细胞,与B细胞、树突状细胞密切相互作用(平均距离分别为56 μm、119 μm)。
该邻域T细胞高表达淋巴组织归巢与组织相关基因(CXCL13、LTB、CCL19)及共刺激分子(CD40、CD28、ICOS),但不具备典型三级淋巴结构的B/T细胞分区与生发中心特征。
肿瘤-T细胞界面:效应T细胞的功能阵地
该邻域T细胞富集干扰素应答、组织驻留及早期活化标志(NR4A1),呈现细胞毒性表型(GZMB⁺CD44⁺),与肿瘤细胞直接接触。
空间依赖的髓系免疫抑制模式
巨噬细胞/单核细胞在不同邻域呈现差异性免疫抑制分子表达:
-
淋巴聚集体:高表达CLEC2D、TGFB1;
-
肿瘤区域:高表达CD276(B7-H3)、VEGFA、SPP1。
提示髓系细胞的空间适应性与局部免疫调节功能分工。
结论:oHSV治疗后GBM微环境中形成功能特化的空间免疫生态位------淋巴聚集体为干细胞样T细胞提供维持与扩增的微环境,而肿瘤-T细胞界面则是效应T细胞执行杀伤功能的前线。髓系细胞在不同区位呈现差异化免疫抑制表型,构成潜在的联合治疗靶点。这一空间区室化组织为理解溶瘤病毒诱导的抗肿瘤免疫应答动力学及优化免疫联合策略提供了结构基础。
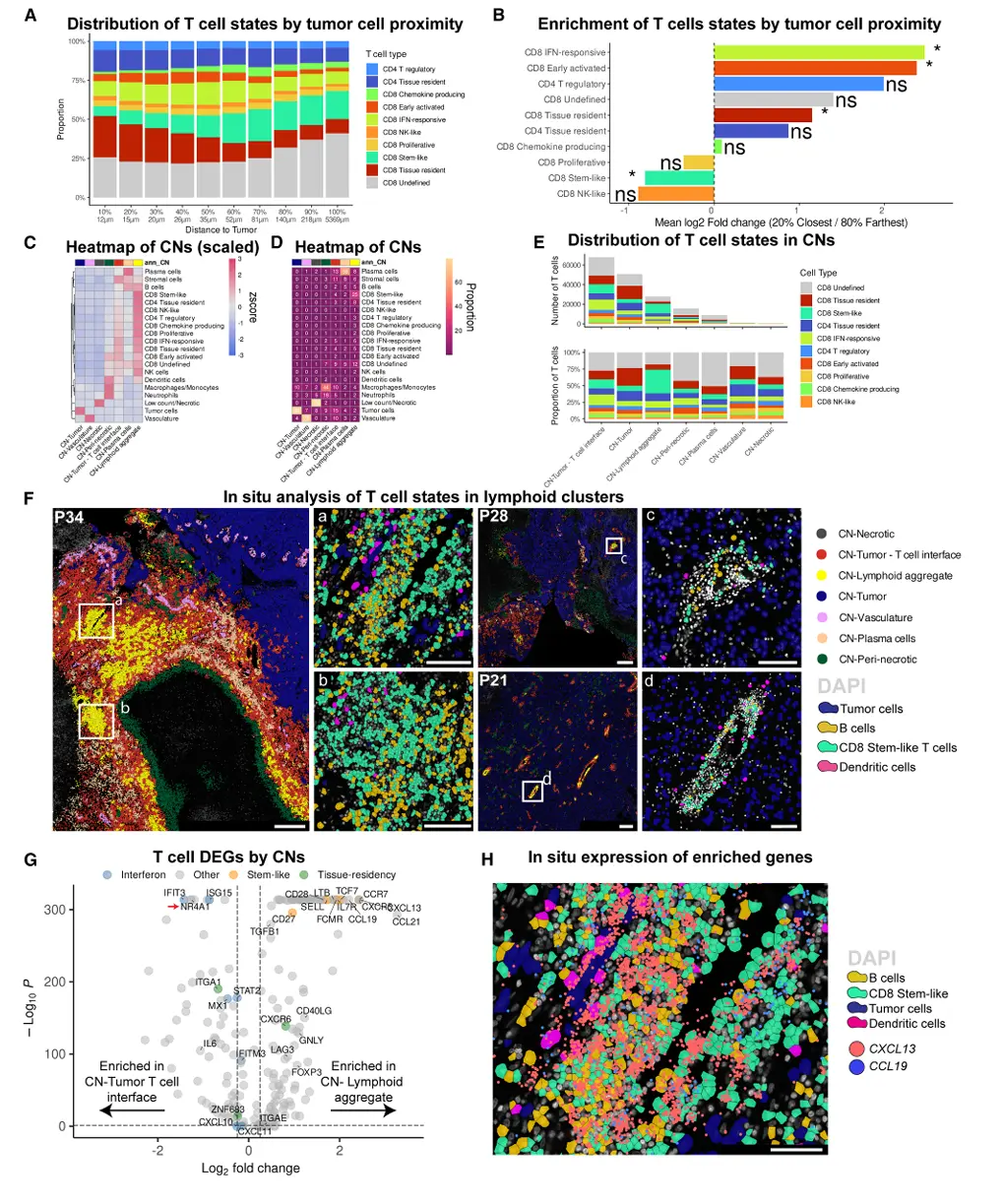
结果5、残留溶瘤病毒局限于坏死肿瘤区域
通过免疫组化与空间转录组学联合分析,明确oHSV治疗后病毒的时空分布特征及其与T细胞的空间隔离:
HSV蛋白与核酸仅定位于坏死区
IHC检测显示,32.1%(9/28)的组织区域呈HSV阳性,但全部局限于DAPI低信号的坏死区域,活性肿瘤区未见病毒染色。
Xenium检测亦证实,仅在4/8例治疗后样本的坏死区检出HSV基因转录本(ICP4、ICP22、ICP27、gC、ICP34.5),治疗前样本及血清阳性患者均无病毒信号。
病毒区域呈现免疫细胞空间区室化
HSV⁺坏死区邻近0--50 μm范围内富集HLA-DR⁺巨噬细胞/单核细胞(log2FC > 1),而CD8⁺与CD4⁺ T细胞显著缺失(log2FC分别为-3.47、-2.01)。
T细胞与HSV⁺区域中位距离>200 μm,且随距离增加逐步富集,形成以坏死灶为中心、髓系细胞环绕、T细胞外围分布的隔离格局。
病毒残留与T细胞效应空间解耦
残留HSV信号仅见于无活性细胞核形态的坏死碎片区,提示检测到的可能为病毒DNA残余。
T细胞深度浸润活性肿瘤区域的现象与病毒抗原无关,治疗后晚期(>6个月)持续的T细胞效应并非由病毒持续存在或局部再激活驱动。
结论:oHSV治疗后病毒复制与存在被严格限制于坏死性微环境,与活性肿瘤浸润T细胞形成明确空间隔离。这一发现排除了病毒持续抗原刺激作为晚期T细胞应答主要驱动力的假设,进一步支持溶瘤病毒诱导的适应性免疫记忆与内源性肿瘤抗原交叉启动机制在维持持久抗肿瘤免疫中的主导作用。
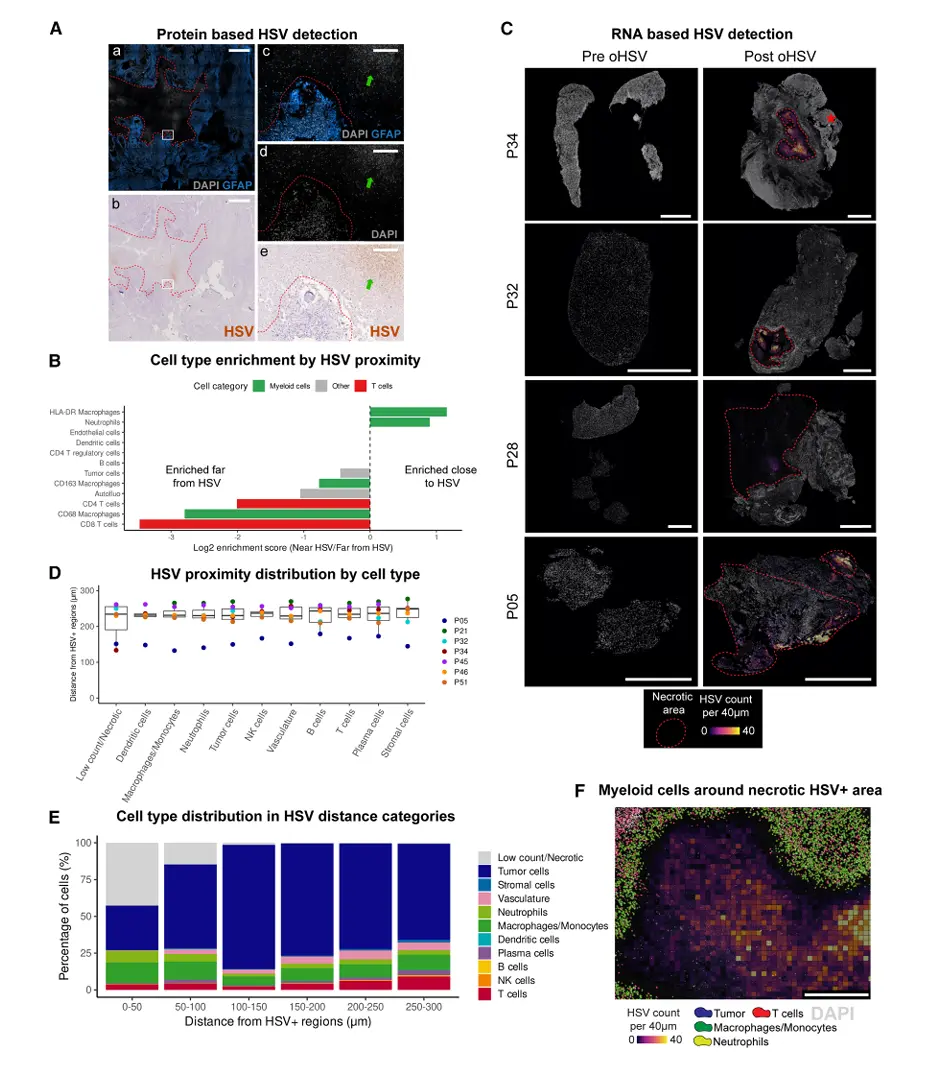
结果6、oHSV扩增预存肿瘤浸润T细胞克隆:特异性、空间定位与临床关联
研究通过TCR测序、空间转录组学及单细胞RNA测序,系统揭示了oHSV治疗后T细胞克隆扩增的起源、特异性、空间动态及其临床意义:
肿瘤局部T细胞克隆显著扩增,外周无系统性应答
治疗后肿瘤组织T细胞克隆性显著增加(p=0.0320),而外周血单核细胞无变化(p=0.62),提示应答高度局限于肿瘤微环境。
部分克隆在肿瘤中扩增达1,024倍,而外周血基线平稳,进一步证实局部克隆扩增为主。
地塞米松暴露削弱T细胞克隆扩增
长期使用地塞米松(>100天)与治疗后T细胞克隆性下降显著相关(r=-0.414,p=0.04),提示糖皮质激素可抑制oHSV诱导的局部T细胞扩增。
扩增T细胞主要来源于预存肿瘤浸润克隆,且非病毒特异性
平均13%的治疗前TCR克隆型在治疗后仍可检出,部分患者共享克隆超200种。
共享克隆扩增型患者总生存期显著优于收缩型患者(中位445天 vs 235天,p=0.033)。
经数据库比对,1,246个扩增克隆中仅15个匹配已知病毒特异性,无一针对HSV,且扩增T细胞高表达肿瘤反应性特征(CXCL13⁺/ITGAE⁺/IL7R⁻),提示其靶向内源性肿瘤抗原。
空间转录组学实现T细胞克隆原位追踪
为两名高T细胞浸润患者(P28、P34)定制35种TCR探针,成功原位检测43个扩增克隆型。
预存克隆在治疗前后样本中均可定位,证实其局部扩增而非新招募。
扩增T细胞富集组织驻留(ITGAE、ZNF683)与细胞毒性(PRF1、IFNG)特征,部分克隆中CD8⁺组织驻留T细胞占比高达50%。
扩增克隆更接近肿瘤细胞,空间邻近性独立于组织驻留表型
扩增TCR标记的T细胞距肿瘤细胞中位距离较其他T细胞近19.6 μm(p < 10e⁻⁴)。
剔除组织驻留T细胞后差异仍显著(中位差18.1 μm),提示肿瘤邻近性反映TCR特异性识别,而非单纯组织驻留表型所致。
结论:oHSV单次治疗可特异性扩增预存的肿瘤浸润T细胞克隆,这些克隆非病毒特异性,而是靶向内源性肿瘤抗原,具备组织驻留与细胞毒性表型,并在空间上优先邻近肿瘤细胞。其扩增程度与患者生存期显著正相关,而地塞米松可削弱这一应答。本研究首次在空间单细胞分辨率下原位示踪T细胞克隆动态,为溶瘤病毒通过扩增预存肿瘤特异性T细胞驱动持久抗肿瘤免疫提供了直接证据。
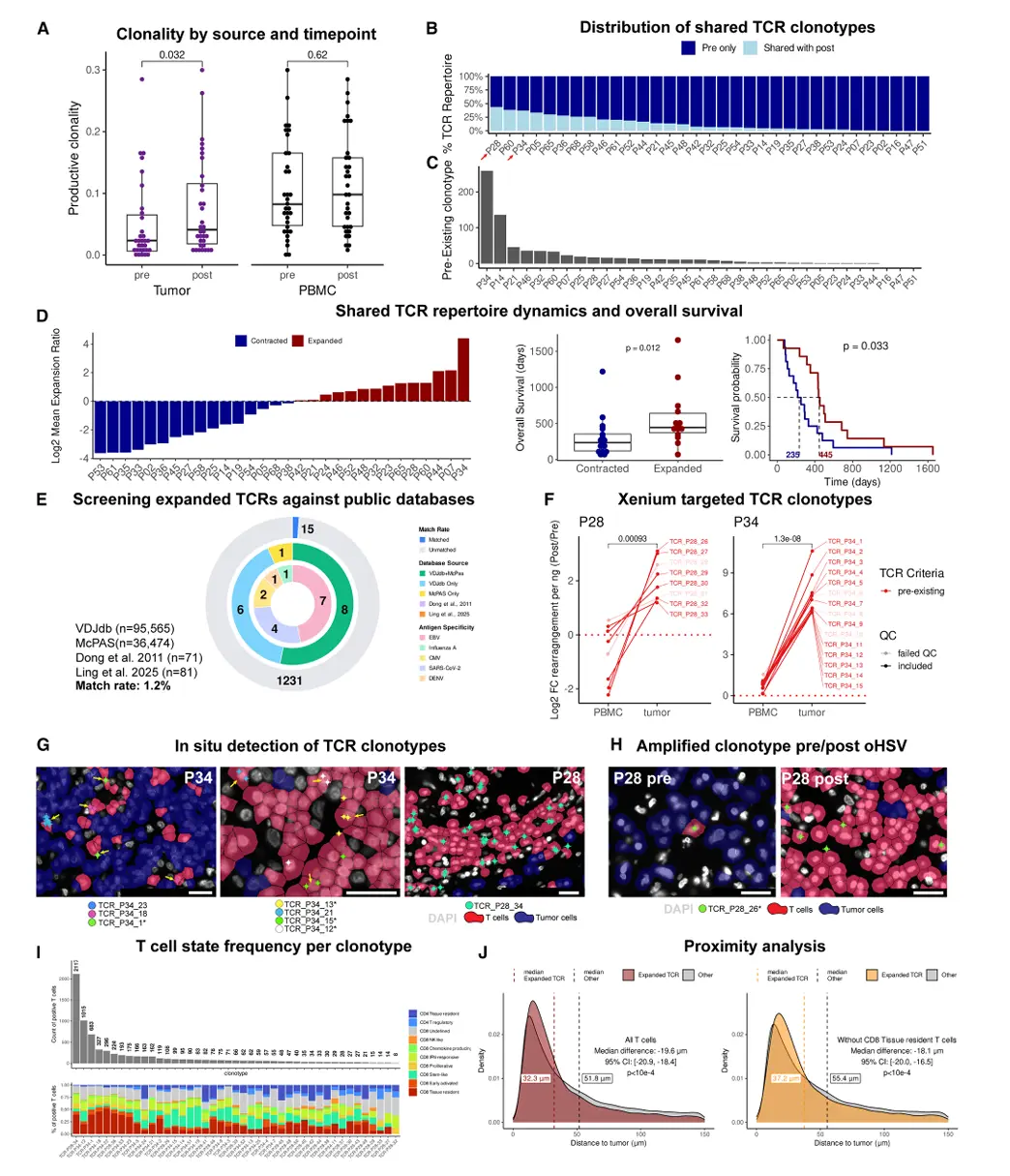
结果7、治疗耐药的空间机制:缺氧间充质亚群介导T细胞排斥
通过空间转录组学解析oHSV治疗后GBM细胞状态重塑及其与T细胞浸润的空间关系,揭示肿瘤内在耐药机制:
治疗后复发肿瘤富集缺氧间充质亚群
六种GBM恶性细胞状态在治疗后均存在,但缺氧MES-like 2亚群从治疗前至复发时显著扩增(log2FC=1.38,p=0.00781)。
该亚群高表达缺氧标志(CA9、ADM、DDIT3、ENO2、HILPDA)及VEGFA。
缺氧MES-like 2区域呈现T细胞排斥
距T细胞最远的肿瘤区域(≥149 μm)显著富集缺氧MES-like 2细胞,其占比在极端远端区(214--3,456 μm)可达78%。
VEGFA高表达缺氧区即使邻近区域存在T细胞浸润,该区域仍呈现明确T细胞排斥。
该排斥现象与HSV存在状态及巢蛋白表达无关,提示由缺氧间充质表型本身驱动。
VEGFA作为缺氧排斥区的空间标志物
VEGFA表达与缺氧MES-like 2基因特征高度相关(r=0.64,p<1e-4),可单独用于定位T细胞排斥性缺氧微环境。
结论:oHSV虽能诱导广泛T细胞浸润,但缺氧间充质亚群(MES-like 2)在治疗后扩增并形成T细胞排斥区,构成潜在的治疗耐药生态位。该区域通过VEGFA等高表达营造免疫排斥微环境,即使整体抗肿瘤免疫应答被激活,仍可导致肿瘤异质性耐药。这一发现为联合抗血管生成或靶向缺氧信号通路以克服溶瘤病毒治疗耐药提供了理论依据。
最后来看看方法
TCR探针


空间数据分析
