大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
N4-乙酰胞苷(ac4C)是一种高度保守的化学修饰,广泛存在于真核和原核生物RNA中,如tRNA、rRNA和mRNA。这种修饰与多种人类疾病显著相关,尤其是癌症,其形成主要依赖于N-乙酰转移酶10(NAT10)(唯一已知ac4C的writer蛋白)的催化活性。本文讨论了ac4C的检测技术及其调控机制,并总结了ac4C与肿瘤发生、发展、预后和药物治疗的相关性。此外还对早期肿瘤诊断和预后预测的新生物标志物以及肿瘤治疗的新靶点进行了评论。
ac4C的调控机制
由于ac4C是一种新发现的RNA修饰,其形成和作用机制尚未被充分探索。到目前为止,只发现了一种ac4C的writer蛋白,而eraser和reader蛋白仍然未知。唯一已知的ac4C writer蛋白NAT10促进RNA中ac4C残基的形成机制还有待研究。
调控因子
调节RNA中ac4C的eraser和reader蛋白尚未被发现。ac4C writer蛋白NAT10最早在2003年被报道,并被揭示具有组蛋白乙酰化活性。NAT10是一种RNA乙酰转移酶,能够催化RNA中ATP依赖性乙酰化形成,是唯一已知的ac4C writer蛋白。NAT10属于G蛋白亚基α转导蛋白(GNAT)超家族的N-乙酰转移酶,可催化组蛋白和非组蛋白蛋白的乙酰化。NAT10蛋白包含一个乙酰酶结构域和一个RNA结合结构域,使其能够在各种转录本(如18S rRNA、tRNA和mRNA)中催化ac4C形成。该催化过程会消耗乙酰辅酶A和ATP,在某些情况下(如tRNA中ac4C形成)需要THUMPD1接头蛋白的协助。此外,ac4C形成还需要snoRNA的反义序列与靶序列结合。而mRNA中ac4C形成所需的辅因子尚未被发现,以及各种RNA中的ac4C位点是否可以去乙酰化仍然未知。
ac4C位点分布及其对RNA的影响
N4-乙酰胞苷修饰在RNA中含量丰富,并在tRNA、mRNA和rRNA中富集(图1)。它于1966年首次在酵母tRNA中被发现,于1978年在rRNA中被发现。这种修饰位于tRNAMet的摆动碱基和tRNASer及tRNALeu的D臂上。NAT10 writer蛋白介导哺乳动物18S rRNA的1842和1337核苷酸上的ac4C修饰。在萌发的Schizomyces sp.和人类结直肠癌HCT 116细胞中,18S rRNA包含两个ac4C位点,第一个位于螺旋34,主要促进维持翻译的准确性;另一个位于螺旋45,在tRNA中形成的ac4C位点提高了蛋白质翻译的保真度,并维持生物体耐热性,而在rRNA中的修饰则增强了蛋白质翻译的准确性。
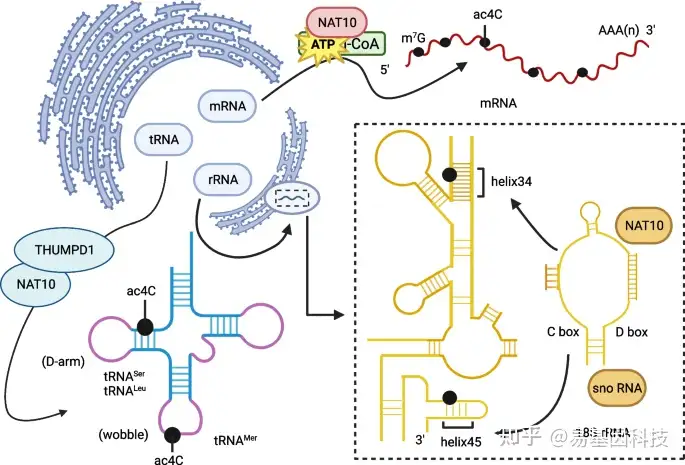
图1:ac4C修饰在mRNA、tRNA和rRNA中的位点
大部分早期研究主要集中在定义tRNA和rRNA中的ac4C修饰,而近年来,研究的重点逐渐转移到mRNA中的ac4C上。mRNA在其polyA尾巴附近的编码序列中ac4C残基富集,这些残基的丰度从基因转录的5′端向3′端逐渐减少。富含ac4C的mRNA具有更长的半衰期。对ac4C peaks密码子组成的生物信息学分析表明,在摆动位点中胞嘧啶强富集。mRNA编码序列中ac4C的存在强刺激了翻译延伸,而5′非翻译区(UTR)中的修饰则调控翻译启动。破坏NAT10活性会消除mRNA定位位点的ac4C,揭示了乙酰化作用提高了mRNA的稳定性和翻译效率。
NAT10酶调控脂肪酸代谢
NAT10酶调控脂肪酸(fatty acid,FA)代谢,这一点在癌细胞的增殖和存活中尤为重要。NAT10缺失的癌细胞表现出增殖和存活率降低,促使科研人员进一步探究背后的原因。越来越多的证据表明,脂肪酸代谢在转移和治疗抗性中扮演着至关重要的角色。因此,探索FA代谢信号通路对于癌症的研究和治疗至关重要。转录组分析揭示了NAT10调控许多与FA代谢相关的基因,包括ELOVL脂肪酸延伸酶6(ELOVL6)、短链/支链酰基辅酶A脱氢酶(ACADSB)、乙酰辅酶A乙酰转移酶1(ACAT1)以及长链酰基辅酶A合成酶家族成员1、3和4(ACSL1、3和4)。此外,NAT10通过催化ac4C形成,提高FA代谢基因的mRNA稳定性,从而调控FA代谢(图2)。研究ac4C对棕榈酸驱动的脂质积累的影响结果表明,NAT10以ac4C依赖性方式调控癌细胞中棕榈酸驱动的FA代谢。乙酰辅酶A是NAT10催化的RNA乙酰化作用的底物,并作为FA代谢通路中的核心分子参与FA代谢。这些发现表明,NAT10参与脂质积累和FA代谢,强调了在癌症的背景下探索其机制的必要性。
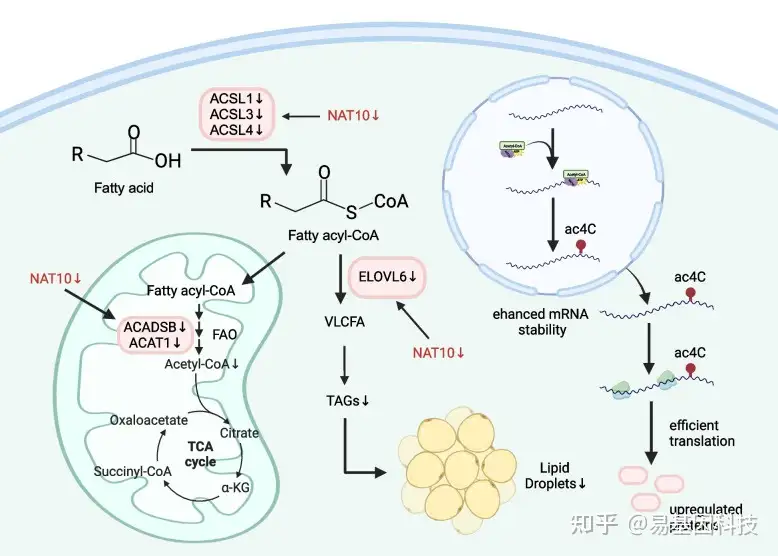
图2:NAT10参与脂肪酸代谢
癌细胞的生长和增殖需要生物分子,包括核酸、蛋白质和脂质。例如,脂质如三酰甘油、胆固醇、二酰甘油和磷脂,对健康细胞和癌细胞的能量供应和膜结构完整性有所功能,并在各种生物过程中作为信号分子发挥作用。NAT10缺失的癌细胞特征是细胞生长和增殖减少,这可能与NAT10缺失导致这些细胞中FA代谢相关基因的ac4C修饰形成减少有关,从而导致脂质水平下降。细胞增殖依赖于FA代谢基因,NAT10在癌细胞中的枯竭引发FA代谢功能障碍,导致细胞死亡。
ac4C检测技术
由于ac4C修饰不影响互补的CG碱基对,在常规RNA测序中无法检测到。为此,科学家们开发了多种检测ac4C RNA的方法(表1),例如高效液相色谱(HPLC)和液相色谱-质谱联用(LC-MS),用于ac4C RNA的定性和定量检测。还开发了一种名为乙酰化RNA免疫沉淀测序(acRIP-seq)的高通量方法,该方法使用靶向ac4C RNA的特异性抗体来获取精确的序列信息。N4-乙酰胞苷测序(ac4C-seq)是另一种化学辅助测序方法,它使用硼氢化物将ac4C还原为N4-乙酰-3,4,5,6-四氢胞嘧啶,并通过对随后逆转录中由N4-乙酰-3,4,5,6-四氢胞嘧啶引起的突变位置以确定ac4C RNA位点。此外还有如PACES和机器学习模型XG-ac4C,用于预测mRNA中的ac4C位点。
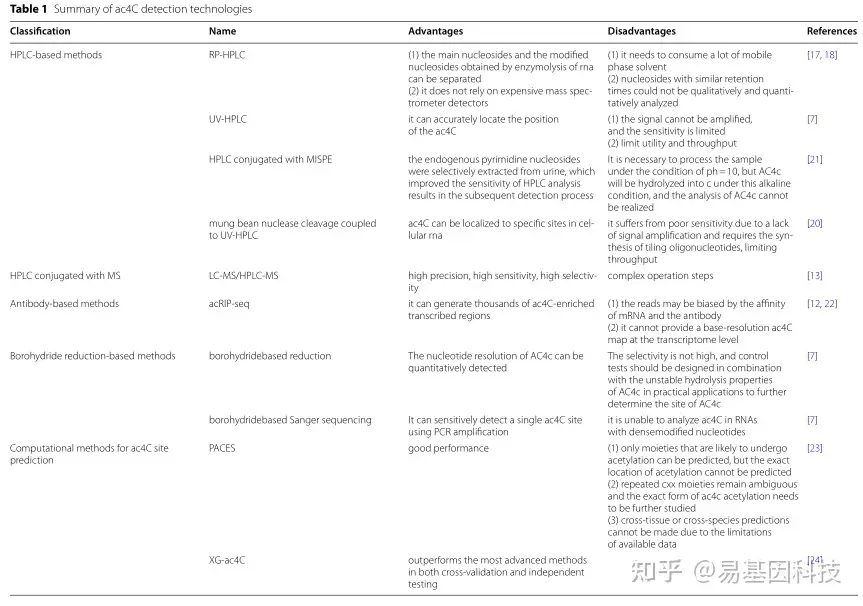
表1:ac4C检测技术总结
基于高效液相色谱法(HPLC)
高效液相色谱法(HPLC)是一种用于分离和鉴定混合物中各个组分的分析技术。基于柱色谱法(column chromatography)的基本原理,HPLC能够将RNA酶解获得的普通核苷和修饰核苷分离出来,从而实现对RNA中不同修饰核苷酸的检测和分析。反相高效液相色谱(RP-HPLC)是一种基于液相色谱技术的分离方法,它利用不同化合物在反相固定相上的亲水性差异进行分离,是检测修饰核苷酸的敏感且有效的方法。在绿豆核酸酶保护实验中使用RP-HPLC来鉴定真核rRNA中螺旋34的ac4C位点,揭示了酵母小核仁RNA(snoRNA)负责介导rRNA乙酰化。
尽管HPLC能够鉴定RNA中的多种修饰核苷酸,但它需要大量的溶剂进行分离,并且不能对具有相似保留时间的核苷酸进行定性和定量分析。此外,基于HPLC的方法无法放大信号,导致灵敏度有限。2008年,Damien等人建立了分子印迹固相萃取(MISPE)技术,用于从尿液中提取嘧啶,提高了随后检测中HPLC结果的灵敏度。然而,由于MISPE需要在pH=10的条件下处理样本,导致ac4C在碱性条件下水解为C,阻碍ac4C分析。
基于液相色谱-质谱法
液相色谱-质谱(LC-MS)是液相色谱(LC)与质谱(MS)的结合体,它通过在高效液相色谱中离子化样品,根据离子的质荷比进行分离,然后使用质谱检测每个离子谱峰的分子量信息,从而实现对样品的分析。LC-MS可以用于翻译后蛋白质修饰和转录后非编码RNA的修饰。例如,Tardu等人尝试使用已建立的HPLC串联质谱方法,通过使用标准物质来同时以高精度、高灵敏度和高选择性检测酵母mRNA中可能存在的核苷酸变体。然而,这种方法过程复杂,并且需要对RNA样品进行复杂的预处理。
基于抗体富集方法
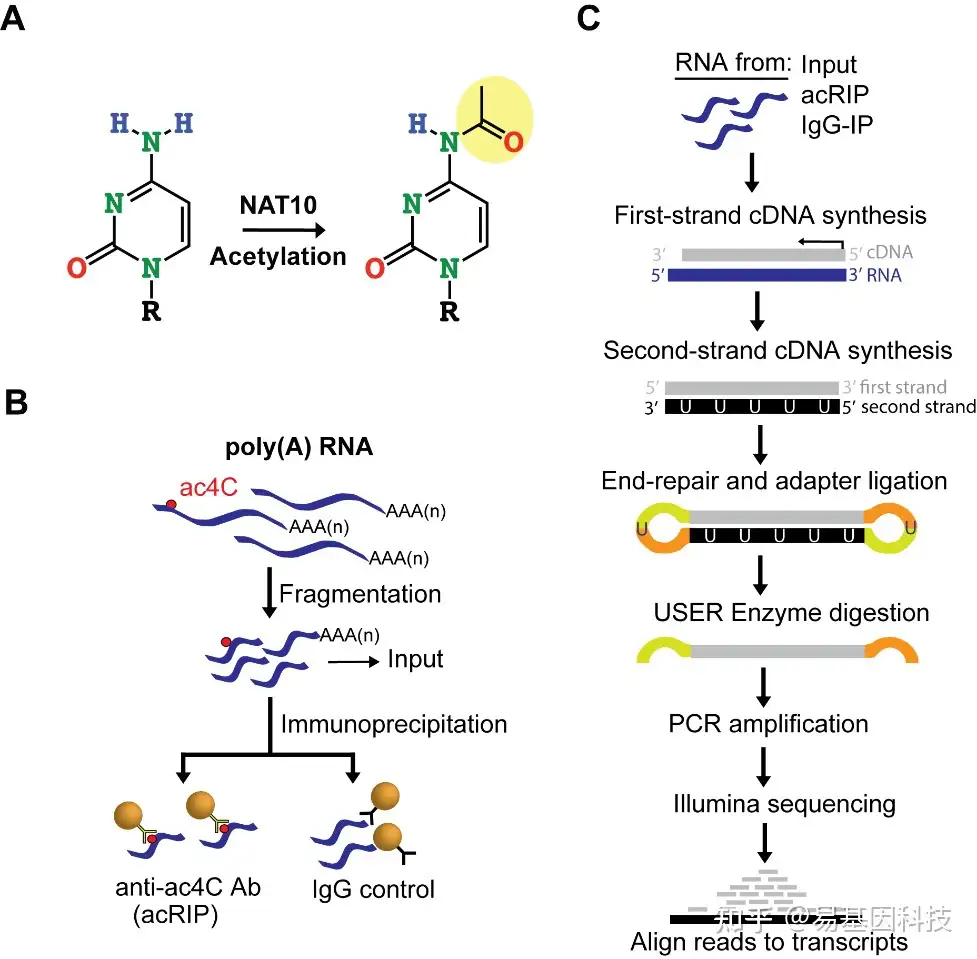
基于抗体的方法使用靶向ac4C抗体来检测RNA序列中的ac4C,通过沉淀修饰过的RNA通过深度测序来鉴定。这些技术具有信号放大的优势,并已用于检测人类和病毒mRNA中的ac4C。2018年,Arango等人使用乙酰化RNA免疫沉淀测序(acRIP-seq)技术富集人类mRNA中的ac4C位点,这是首次在4000多个区域中鉴定出这些位点,并揭示其与翻译起始、mRNA定位和翻译抑制调控相关。这项技术(图3A)基于抗体特异性结合RNA样本中ac4C残基的原理,样本被处理成较小的RNA片段,并与ac4C抗体或同源单克隆IgG对照混合进行免疫沉淀;随后进行高通量测序以鉴定发生乙酰化的RNA区域。尽管这种方法产生了数千个富集ac4C的转录区域,但reads结果可能受到mRNA和抗体亲和力的影响。
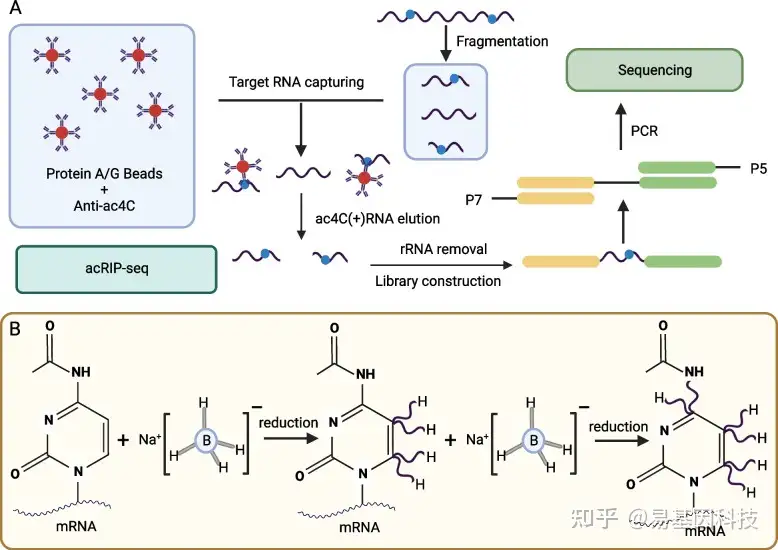
图3:用于检测RNA ac4C 修饰的两种方法。A. 基于抗体方法;B. 基于硼氢化物还原法
硼氢化物还原法
由于ac4C修饰中吡啶环的电子密度显著低于胞嘧啶,因此ac4C容易被硼烷还原。同时ac4C也容易在碱性条件下发生去乙酰化。基于ac4C的这些化学特性,研究人员开发了一种称为ac4C-seq的新检测方法。2018年,Thomas等人使用硼氢化物还原法在单碱基分辨率下检测18S rRNA中的ac4C。在这种方法中,氰化硼氢化钠在酸性条件下将ac4C还原为N4-乙酰-3,4,5,6-四氢胞嘧啶(图3B)。在逆转录过程中,被还原的碱基被误读为U而不是C,使得后续cDNA测序(ac4C-seq)中可以在ac4C位点观察到C到T突变。然而,这种反应的选择性较低,因为氢化物也可以还原包含其他电子缺失杂环的碱基修饰。因此,在实际应用中,应设计对照试验,结合不稳定ac4C的水解特性,以更高准确性确定ac4C位点。
ac4C-seq相较于其他方法的主要优势在于能够在核苷酸分辨率下定量检测ac4C,并且适用于检测ac4C反应动态。其灵敏度主要取决于ac4C的化学计量比和测序深度,理论上可以通过使用抗体预富集含ac4C的RNA样本来提高。然而,它的最大局限性在于它完全依赖于C到T检测,可能会在测序过程中低估RNA上修饰的丰度。
预测ac4C位点的计算方法
尽管人类转录组中ac4C修饰分布广泛,但使用前述方法只检测到少数带有修饰序列的转录本。Zhao等人开发了一种名为PACES的基于机器学习的ac4C预测器,有助于挖掘用于input的人类mRNA乙酰化序列。PACES在motif水平上进行预测,通过结合特定位点的二核苷酸序列谱(PSDSP)和K-核苷酸频率(KNF)获取序列特征。尽管这种方法在交叉验证和独立基准测试中预测ac4C位点方面表现出良好的性能,但它有一些局限性。首先,由于高通量检测鉴定ac4C修饰的分辨率有限,PACES只预测可能发生乙酰化的motif,而不是确切位点。其次,重复的CXX motif仍然不清楚。第三,由于可用数据有限,PACES无法预测不同组织或物种。
此外,Alam等人提出了一个名为XG-ac4C的计算模型,该模型基于XGboost算法来确定mRNA中的ac4C修饰位点。对XG-ac4C模型的评估表明,它在交叉验证和独立测试中的性能优于最先进的方法。
ac4C在癌症中的作用
癌症是一种严重威胁人类健康的疾病,其发展进程与RNA ac4C修饰形成有关。NAT10 writer蛋白在肿瘤组织中高表达,催化多种与癌症相关的基因编码RNA ac4C残基形成,从而促进肿瘤进展(表2)。因此,未来关于ac4C修饰相关作用研究应该揭示其在肿瘤进展中的机制,以提供早期肿瘤诊断和治疗的新思路和方法。新的治疗方法可能会提高癌症患者的生存率和生活质量。
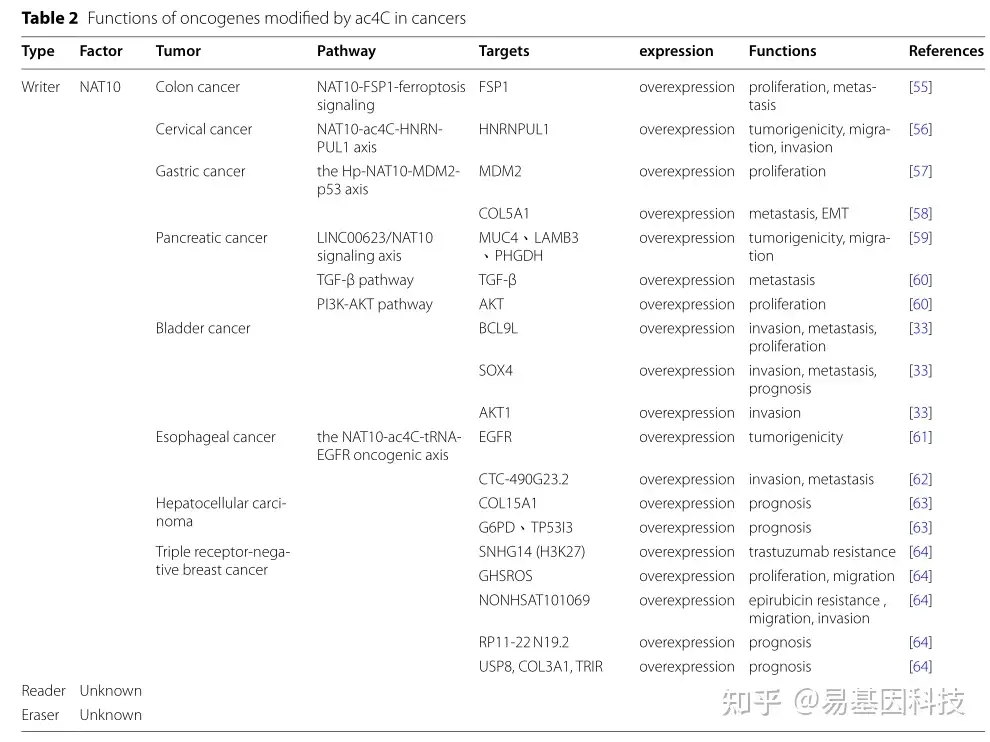
表2:ac4C修饰致癌基因在癌症中的功能
结直肠癌(Colon cancer)
结直肠癌是一种常见的消化道恶性肿瘤,也是全球癌症相关死亡的主要原因之一,30%~50%的结直肠癌患者在治疗后5年内出现复发、转移或死亡。尽管近年来结直肠癌的筛查和治疗策略有所改善,但晚期结直肠癌患者的预后仍然不佳,主要是因为疾病的分子机制仍然不清楚。因此,研究这些机制对于发现预测结直肠癌发生或改善患者预后的有效靶向治疗策略非常必要。
Zheng等人通过慢病毒转导建立了NAT10敲低和过表达细胞系,以研究NAT10在结直肠癌中的作用。研究结果表明NAT10水平与细胞增殖显著相关;敲低该蛋白显著抑制细胞增殖。其他研究表明NAT10促进结直肠癌细胞增殖,且增强结直肠癌细胞进展的机制在细胞周期的G0/G1至G2/M期活化。此外,NAT10参与结直肠癌细胞转移;下调NAT10可抑制细胞迁移并减少侵袭性癌细胞数量。总之,NAT10在结直肠癌中表达上调,并与预后不良相关。
为进一步探索NAT10促进结直肠癌细胞增殖和转移的潜在分子机制,Zheng等人进行了转录组学分析实验,结果表明在NAT10敲低细胞中,铁死亡抑制蛋白1(FSP1)表达失调。Dalhat等人探讨了NAT10和FSP1蛋白之间的关系,发现NAT10通过FSP1在癌细胞中作为铁死亡通路的表观遗传转录组调控因子。实时荧光定量PCR和Western blotting证实,在NAT10过表达细胞中FSP1表达增加,而在NAT10敲低细胞中减少。此外,ac4C乙酰化的FSP1 mRNA的水平在NAT10敲低细胞中持续下降,但在过表达细胞中上升,与蛋白表达一致。总结来说,NAT10通过催化FSP1 mRNA中的ac4C形成来增强其在结直肠癌细胞中的稳定性,从而上调FSP1表达。FSP1蛋白是一种谷胱甘肽非依赖性铁死亡抑制剂。NAT10敲低细胞还表现出增强的GSH消耗和增加的脂质活性氧、铁离子和丙二醛水平。此外,这些细胞的透射电子显微镜观察显示线粒体基质凝聚并形成扩大的嵴,表明敲低NAT10在结直肠癌细胞中诱导铁死亡。Ferrostatin-1是一种合成抑制剂,可抑制铁死亡所需的脂质过氧化。Ferrostatin-1抑制的铁死亡不影响载体对照细胞的增殖和转移,但在NAT10敲低细胞中增加了这两个过程。
这些研究表明,抑制铁死亡可以逆转NAT10下调介导的结直肠癌细胞增殖和转移抑制。总结来说,NAT10通过催化FSP1 mRNA ac4C形成来增强FSP1 mRNA稳定性,从而上调FSP1表达。FSP1表达上调反过来抑制结直肠癌细胞的铁死亡,促进了其增殖和转移(图4A)。
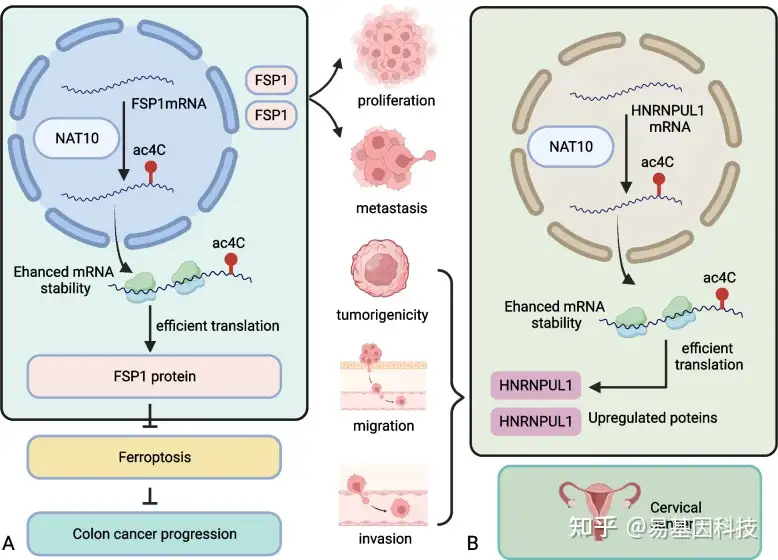
图4:NAT10参与肿瘤进展的相关机制。
- NAT10介导的FSP1 mRNA ac4C参与结直肠癌进展。
- NAT10介导的HNRNPUL1 mRNA ac4C参与宫颈癌进展。
子宫颈癌(Cervical cancer)
宫颈癌是生殖系统中最常见的恶性肿瘤,也是女性中发病率和死亡率最高的癌症之一。近年来,这种疾病在年轻女性中的发病率有所上升,人乳头瘤病毒(HPV)感染是其最重要的危险因素。但并非所有HPV感染患者都会发展成宫颈癌,表明HPV感染不足以导致疾病的发生。实际上,表观遗传事件可能是疾病发生所必需的。由于宫颈细胞学筛查的广泛使用,可以在早期发现和治疗,近几十年来宫颈癌的发病率和死亡率显著下降。然而,由于各种治疗方法(手术、放疗、化疗、免疫治疗等)对晚期或复发宫颈癌患者的临床效果较低,这些患者的预后仍然不佳。因此,研究宫颈癌的分子机制和寻找新的生物标志物对提高患者生存率至关重要。
Long等人通过转录组分析发现,NAT10在宫颈癌细胞中表达上调,敲除NAT10可以抑制其增殖、侵袭和迁移。异种移植模型证实了NAT10的致癌功能。最近的证据表明,NAT10在宫颈癌中的标靶是异质核糖核蛋白U样1(HNRNPUL1)。NAT10蛋白通过催化ac4C形成并增加HNRNPUL1 mRNA的稳定性来调节宫颈癌细胞中HNRNPUL1表达。总之,NAT10通过ac4C修饰增强HNRNPUL1 mRNA的稳定性,促进宫颈癌发展(图4B)。
采用数据库分析方法研究NAT10与宫颈癌细胞恶性行为之间的关系。研究结果表明,NAT10高表达与宫颈癌患者的不良预后相关。这些细胞中NAT10过表达可以提高其生长和增殖,并促进侵袭和迁移。生物信息学分析显示,盘状蛋白结构域受体酪氨酸激酶1(DDR1)可能是NAT10的下游靶基因。Western blotting和RT-qPCR结果揭示NAT10过表达显著上调DDR1蛋白和mRNA水平,表明NAT10通过催化DDR1 mRNA中的ac4C来增加DDR1表达。因此,NAT10通过乙酰化提高DDR1 mRNA稳定性,促进宫颈癌细胞的生长、增殖、侵袭和迁移。
胃癌(GC)
GC是消化系统中常见的恶性肿瘤,也是全球癌症相关死亡的第四大原因。这种疾病通常由幽门螺杆菌(Helicobacter pylori)感染引起。早期胃癌患者在手术治疗和辅助疗法后病情有显著改善,5年生存率超过90%。然而,晚期疾病患者的预后仍然较差,5年生存率不到25%。因此,了解潜在的机制并开发新的靶向治疗方案对于改善胃癌患者的临床预后非常必要。
Deng等人研究了ac4C修饰与胃癌发生之间的关系,发现与健康细胞相比,GC细胞中NAT10显著上调。幽门螺杆菌感染有助于NAT10诱导,通过MDM2原癌基因(MDM2)调节p53稳定性。NAT10酶催化MDM2 mRNA中的ac4C形成,提高其稳定性和过表达。MDM2表达增强会降解p53,促进胃癌发生(图5A)。在人类胃癌AGS细胞中敲除NAT10可减少总RNA和mRNA的ac4C修饰,并抑制肿瘤细胞的增殖和侵袭。此外,细胞还会经历显著的G2/M细胞周期停滞和凋亡。当细胞用NAT10抑制剂Remodelin处理时,这些NAT10效应被逆转,表明其抗胃癌活性。
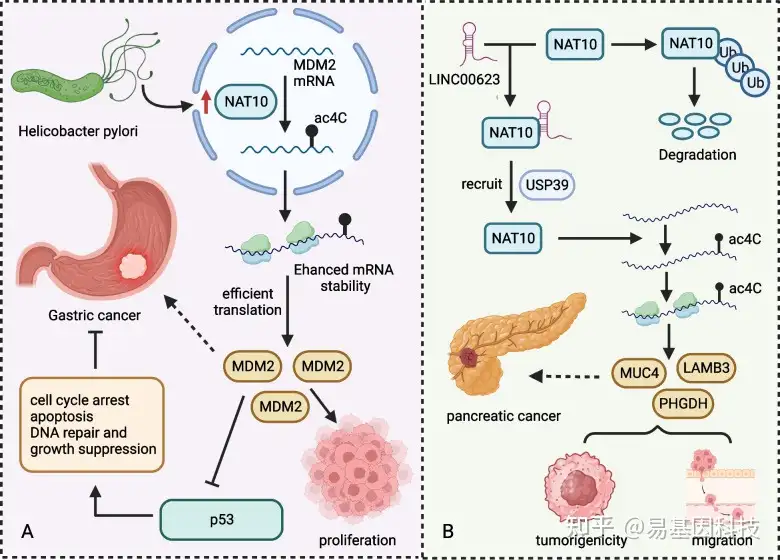
图5:NAT10相关通路与肿瘤发展有关。
- HP-NAT10-MDM2-p53信号轴促进GC发育。
- LINC00623 lncRNA-NAT10信号轴促进胰腺癌进展。
在胃癌(GC)中,NAT10过表达还通过ac4C形成来上调V型胶原蛋白α1链(COL5A1),促进胃癌的上皮-间质转化(EMT)和转移。Zhang等人进行体内外实验以研究NAT10与胃癌恶性转化之间的关系。研究结果表明NAT10表达下调抑制胃癌细胞迁移,而NAT10过表达则增强胃癌细胞迁移。研究还使用Western blotting、RT-qPCR和免疫荧光证实了NAT10促进胃癌细胞中EMT进展。
胰腺癌(Pancreatic cancer)
胰腺癌是一种高度恶性的肿瘤,是世界上癌症死亡的第七大原因。治疗胰腺癌面临许多挑战,主要源于晚期诊断和治疗抗性。尽管手术有潜力治愈胰腺癌,但通常需要联合治疗干预,其不良反应经常严重影响患者的生活质量。因此,开发具有高特异性和敏感性的新诊断方法和治疗策略是当前研究工作的重点。
Xu等人收集了胰腺癌组织的基因组数据,并构建NAT10亚组表型,以评估NAT10水平与胰腺癌患者的临床病理特征之间的关联。该团队发现NAT10参与疾病的临床结果以及肿瘤组织浸润、药物抗性、迁移和克隆形成潜力。他们指出胰腺癌组织表现出异常增加的NAT10表达,并且异常表达的患者预后较差。此外,他们还展示了癌细胞组织中AKT丝氨酸/苏氨酸激酶(AKT)的激活与细胞增殖正相关。因此,异常的NAT10表达可能通过触发PI3K-AKT通路促进胰腺癌的恶性增殖。NAT10异常表达还促进TGF-β信号和血管生成,促进胰腺癌细胞的转移。使用两种siRNA敲低NAT10可以减少胰腺癌细胞的集落形成和迁移能力。吉西他滨是不可切除的局部晚期或转移性胰腺癌的一线治疗方案。Xu等人研究结果揭示NAT10高表达会增加胰腺癌细胞对吉西他滨治疗的抗性。这项研究得出结论,NAT10通过介导mRNA中ac4C修饰形成,促进肿瘤细胞迁移和吉西他滨抗性。总之,NAT10下调抑制胰腺癌细胞的迁移和克隆形成能力,并减少其对吉西他滨的抗性,这可能是胰腺癌治疗的潜在靶点。
Feng等人鉴定出一种新的长链非编码RNA(lncRNA)LINC00623,并验证其在胰腺癌患者的诊断价值。研究表明LINC00623 lncRNA在体内外促进胰腺癌细胞的肿瘤发生性和迁移。从机制上讲,LINC00623 lncRNA在肿瘤组织中上调并与NAT10结合,招募泛素特异性肽酶39(USP39)以抑制NAT10泛素化依赖性降解,从而促进mRNA中ac4C修饰形成,增强基因表达并导致肿瘤发生(图5B)。研究团队还揭示了抑制因子ASO-LINC00623可以抑制LINC00623 lncRNA表达,并显著减少胰腺癌细胞的增殖和EMT,表明其作为胰腺癌治疗的巨大潜力。总的来说,这些数据表明LINC00623 lncRNA是胰腺癌的潜在治疗靶点。
膀胱癌(Bladder cancer)
膀胱癌(BLCA)是泌尿系统中常见的恶性肿瘤。每年约有55万新发病例,使其成为全球第12位最常见的恶性肿瘤。BLCA发病率每年都在增加,而且治疗完全切除后的复发和晚期疾病仍然是一个巨大的挑战。因此,迫切需要识别生物标志物和有效治疗策略。
与健康组织相比,BLCA组织中的NAT10表达显著较低。NAT10水平与肿瘤侵袭性呈正相关,淋巴结转移患者的NAT10蛋白水平较高。NAT10表达水平较低的患者的整体生存率高于表达水平较高的患者,这表明NAT10表达可以预测BLCA预后。抗NAT10及其基因敲除可以延缓BLCA进展,以NAT10为靶点可能是BLCA治疗的新策略。此外,BLCA组织中NAT10高表达可能是预后不良的预测指标。
Wang等人发现NAT10在BLCA组织中高表达,并通过催化靶转录本中的ac4C修饰促进肿瘤增殖和迁移。研究小组使用全转录组acRIP-seq研究了NAT10定位和特定修饰中ac4C修饰的下游基因。鉴定出NAT10直接与3个富含ac4C的靶标相结合:BCL9样蛋白(BCL9L)、SRY盒转录因子4(SOX4)和AKT1。在敲除NAT10后,这些靶标表达显著降低,表明NAT10增强其表达。此外,NAT10通过乙酰化下游靶标在体内促进增殖和肿瘤形成。例如BCL9L与肿瘤侵袭性、迁移能力、细胞多形性和肿瘤进展呈正相关。BCL9L低表达患者生存时间显著大于高表达患者,表明该基因可能作为BLCA预后指标。SOX4表达与肿瘤侵袭能力呈正相关,SOX4高表达患者更有可能发生淋巴结转移。早期BLCA患者SOX4水平较低,晚期较高,表明SOX4高表达与较差预后密切相关。AKT1表达也与肿瘤侵袭和迁移有关。
食管癌(Esophageal cancer)
食管癌是一种高侵袭性的恶性肿瘤,每年导致40万人死亡,是世界上第八大常见癌症。患有这种疾病的患者死亡率高,预后差。最近的临床试验表明,晚期疾病患者可以从吉非替尼治疗中受益,但其响应率较低。研究食管癌发展和药物抗性的分子机制,并制定有效的治疗策略至关重要。
Yu等人使用一种分析核苷酸分辨率的ac4C位点的方法,来确定长链非编码RNA(lncRNA)是否含有ac4C修饰。该团队发现NAT10在CTC-490G23.2 lncRNA中催化ac4C形成,诱导原发性食管癌和转移组织中的转录表达。还证明CTC-490G23.2 lncRNA与肿瘤细胞的侵袭和转移有关。从机制上讲,该转录本促进CD44 pre-mRNA与多嘧啶轨迹结合蛋白1(PTBP1)结合,将pre-mRNA剪接从常见的变体异构体(CD44s-CD44v)转变为肿瘤相关变体异构体。因此,肿瘤相关变体异构体CD44v与肌动蛋白结合并增加其稳定性,表明CTC-490G23.2 lncRNA过表达刺激了癌细胞中的上皮-间质转化(EMT)。由于CTC-490G23.2 lncRNA和CD44v mRNA的高表达与较差的预后相关,这些转录本可能是食管癌的预后生物标志物。此外,反义寡核苷酸(ASOs)靶向CTC-490G23.2 lncRNA显著抑制癌症转移。这些发现将加深对lncRNA ac4C修饰的理解,并为开发新的治疗策略提供有效的治疗策略。
Wei等人进行了多项研究以验证NAT10参与食管癌的发生和发展。该团队研究结果表明,NAT10在食管癌组织中过表达,并与疾病预后相关。此外,NAT10缺失会减少对最佳mRNA翻译效率至关重要的ac4C修饰tRNA库。研究进一步确定表皮生长因子受体(EGFR)蛋白是NAT10的下游靶标,促进其致癌功能。吉非替尼是一种EGFR抑制剂,可以提高晚期食管癌患者的存活率。然而由于药物抗性,其作为二线治疗的广泛临床应用受到抑制。Wei等人发现NAT10促进食管癌细胞对吉非替尼治疗的抗性。NAT10缺失和吉非替尼治疗协同抑制癌细胞侵袭和迁移,表明这种方法可减缓吉非替尼抗性,并为开发有效的癌症治疗策略提供了新的见解。
肝细胞癌(Hepatocellular carcinoma)
肝细胞癌(HCC)是肝癌中占比最高的一种亚型,占原发性肝癌病例的90%。在中国,HCC患者的五年生存率仅为12%,这种疾病通常由多种风险因素引起,尤其是乙型肝炎病毒感染。HCC一线治疗包括放疗、化疗、手术切除和肝移植。然而由于HCC具有复杂的病理机制、快速增殖、广泛侵袭和转移,患者从治疗中获益有限,并且容易复发和转移,导致预后较差。因此,发现新的HCC生物标志物用于早期诊断,以及探索HCC发生和发展的分子机制,对于改善癌症预后非常必要。
Liu等人建立了一个ac4C评分模型来研究ac4C mRNA修饰在HCC发展和进展中的作用。研究团队鉴定了肿瘤和健康组织之间差异表达基因,并选择了3个基因来构建风险模型(ac4C评分):XV型胶原蛋白α1链(COL15A1)、葡萄糖-6-磷酸脱氢酶(G6PD)和肿瘤蛋白p53诱导蛋白3(TP53I3)。该模型将患者分为两个具有不同预后的组。研究团队使用生物信息学工具来确认ac4C评分与肿瘤干性或肿瘤微环境浸润之间的关系,表明ac4C评分是预测HCC患者预后的一个合适生物标志物。
三阴性乳腺癌(TNBC)
乳腺癌是女性中最常见的恶性肿瘤,中国过去几年的发病率显著增加。三阴性乳腺癌(TNBC)为人类表皮生长因子受体2(HER2)、雌激素和孕激素受体均不表达(称为三阴),这导致其高度恶性并加大其治疗难度。TNBC患者寿命短、早期复发率高、预后差。TNBC不能从乳腺癌的内分泌治疗或抗HER2靶向治疗中获益。
Zhang等人收集了TNBC组织样本,并根据NAT10表达对其进行分类,以了解ac4C修饰在TNBC进展中的作用,并帮助设计新的个性化治疗计划和预后评估。该研究团队发现在NAT10高表达和低表达组之间有703个lncRNAs差异表达,其中20个lncRNAs与疾病预后相关。结果表明,NAT10通过ac4C修饰调节lncRNA表达,影响TNBC预后。最终,了解lncRNAs的机制将帮助预测TNBC细胞的药物靶标和药物敏感性。
易小结
NAT10蛋白是首个被证明能够催化RNA乙酰化的酶。尽管对NAT10的研究有限,但它揭示了这种酶在多种恶性肿瘤发展中的关键作用。NAT10通过在多种RNA物种中催化形成ac4C修饰(图6),参与多种肿瘤进展,并且在多种癌症中过表达。在结直肠癌细胞中,通过FSP1乙酰化修饰上调FSP1表达,抑制铁死亡,但促进其转移和增殖。在胰腺癌中,NAT10过表达通过激活PI3K-AKT通路促进恶性细胞增殖。新发现的LINC00623 lncRNA与NAT10结合,促进去泛素化酶USP39招募,并减少NAT10泛素化依赖性降解。LINC00623 lncRNA抑制剂(ASO-LINC00623)显著减少肿瘤负荷。在膀胱癌(BLCA)中,NAT10过表达通过乙酰化修饰BCL9L、SOX4和AKT1,促进肿瘤侵袭和转移。在胃癌(GC)中,NAT10过表达通过乙酰化上调MDM2和COL5A1 mRNA表达,促进胃癌发生和转移。在食管癌中,NAT10过表达通过CTC-490G23.2 lncRNA乙酰化进一步上调,促进肿瘤侵袭和转移。在肝细胞癌(HCC)和三阴性乳腺癌(TNBC)中NAT10上调,但其在这些癌症中的详细机制需要进一步研究。在宫颈癌中,NAT10过表达通过促进乙酰化诱导HNRNPUL1和DDR1 mRNA表达,增强肿瘤增殖、侵袭和转移。此外,NAT10在其他未讨论的恶性肿瘤中也有异常表达,如黑色素瘤、上皮性卵巢癌和非小细胞肺癌。然而,我们没有讨论它在这些癌症中的生物学功能和作用,因为其未知性需要进一步探索。
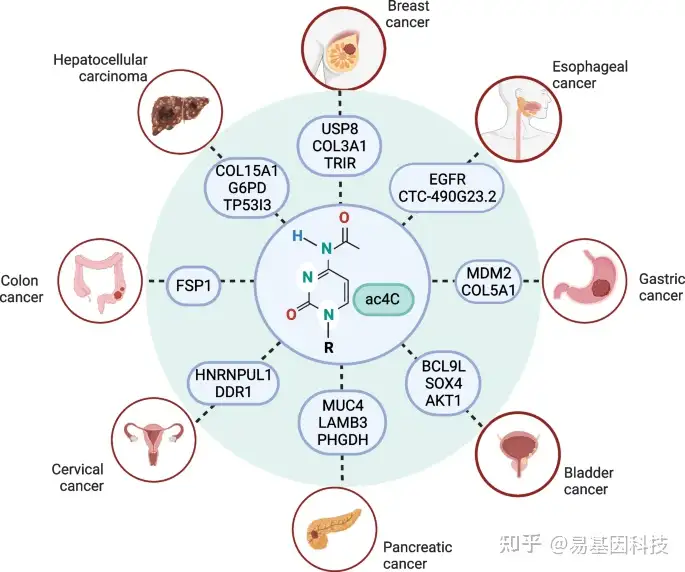
图6:本文所述癌症及其相关ac4C修饰癌基因总结图
ac4C修饰是一种新发现的RNA修饰,其研究尚不完整。到目前为止,只发现了一种writer蛋白。Eraser蛋白、reader蛋白和其他writer蛋白是否存在仍有待研究。NAT10催化RNA中ac4C修饰参与肿瘤发展的具体机制尚不清楚。其次,一些研究发现Remodelin在某些癌症中具有抗癌活性,并可能作为癌症治疗的新靶点。脂肪酸代谢在脂质积累中起着至关重要的作用,脂质物质对能量供应和膜结构完整性至关重要。先前的研究表明,NAT10可以介导脂肪酸代谢关键基因的ac4C修饰,调控基因表达,并影响脂质形成。然而,没有研究证明这种通路与癌症进展之间的相关性,这可以作为进一步研究的方向。
关于易基因ac4C乙酰化RNA免疫沉淀测序(acRIP-seq)
ac4C RNA乙酰化(N4-acetyicytidine,ac4C),N4位乙酰胞嘧啶,是真核原核生物中保守的化学修饰,早期研究认为ac4C主要存在于tRNA和18S rRNA上。近期研究显示,mRNA上也存在大量的ac4C,该修饰在促进蛋白翻译、影响RNA稳定性和可变剪接、调控基因表达发挥重要作用,是继m6A修饰之后表观转录组学的新兴发展方向。
ac4C RNA修饰的检测,易基因采用基于抗体富集的ac4C RNA乙酰化免疫共沉淀 (acetylated RNA Immunoprecipitation,acRIP)技术:基于抗体特异性结合乙酰化修饰碱基原理,以RNA免疫共沉淀富集乙酰化修饰片段为基础,然后通过高通量测序(acRIP-seq),在转录组范围内研究发生乙酰化的RNA区域,高效获得结果。
易基因提供适用于不同科研需求的acRIP -seq技术:
- ac4C 乙酰化-常量mRNA acRIP -seq
- ac4C 乙酰化-常量mRNA +lncRNA acRIP -seq
- ac4C 乙酰化-微量mRNA +lncRNA acRIP -seq
实验原理:
首先通过poly(A)捕获RNA,将获得的RNA打成100nt左右的小片段;之后使用ac4C特异性抗体进行免疫共沉淀,含有ac4C修饰的RNA片段被富集并回收;进而对回收的RNA进行文库构建、高通量测序和生物信息学分析,通过peak分析鉴定出ac4C修饰的位点。
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.
参考文献:
Zhang S, Liu Y, Ma X, Gao X, Ru Y, Hu X, Gu X. Recent advances in the potential role of RNA N4-acetylcytidine in cancer progression. Cell Commun Signal. 2024 Jan 17;22(1):49. pii: 10.1186/s12964-023-01417-5. doi: 10.1186/s12964-023-01417-5. PubMed PMID: 38233930.
相关阅读:
1. MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
3. 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
5. 高通量测序后的下游实验验证方法------m6A RNA甲基化篇
7. 干货:m6A RNA甲基化MeRIP-seq测序分析实验全流程解析
8. m6A peak鉴定经典点软件exomPeak原理解析
9. MeRIP-seq综合分析肺腺癌中的转录组m6A甲基化组
10. RNA m⁶A甲基化测序(MeRIP-seq)技术介绍
11. Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
12. NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
13. 干货:手把手教你做RNA m5C甲基化测序分析(RNA-BS)