如题,生信基地的小伙伴前两天参加了场学术会议,简单记录一下此次参会的收获。
校长报告


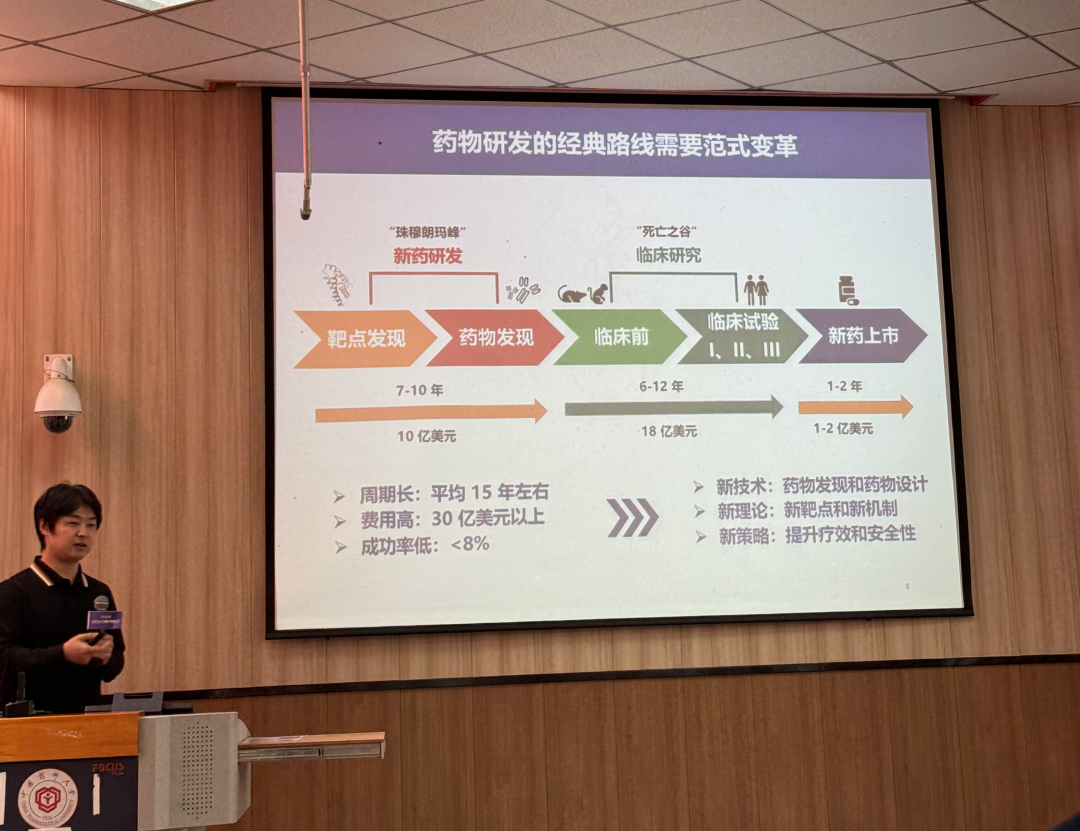
人工智能如何重塑药物研发的未来?智能药学将如何推动医药产业转型升级?是加速进程还是改变范式?首先上午第一场报告由校长提出三个关乎医药产业发展的核心问题,指出新药研发的产出投入比逐年降低,全球范围内新药的出现几率越来越低,然后提出了人工智能在药物研发中的应用,并指出当前我国人工智能辅助药物研发技术远远落后于其他国家。他强调要推动人工智能、药学、生命科学和医学领域的专家联手形成新兴的智能药学交叉学科。他还透露学校将在南京江北新区建立一个实验室,期待全球专家学者的加入,各位如果有这方面的想法并且对ai辅助药物设计有深入研究的可以了解一下。
基于物理模型与人工智能的药物设计

上午第二场由北大教授来鲁华报导,介绍了他们团队的一些最新进展:
LigBuilder V3: A Multi-Target de novo DrugDesign Approach
来鲁华课题组在《Frontiers in Chemistry》发表研究,推出首个从头多靶点药物设计程序 LigBuilder V3,该程序基于遗传算法,创新定义 "构象群""化学簇""构象簇" 等数据结构,通过多目标从头设计、多目标增长、多目标连接三种策略,可设计靶向多个受体、一个受体多个结合位点或多种构象的配体,其开发的集成连接算法能提升片段连接效率,经设计 HIV 蛋白酶和 HIV 逆转录酶双功能抑制剂验证,相关化合物通过 MM/GBSA 结合自由能估计显示出较高多靶点药物潜力,可在官网下载(http://www.pkumdl.cn:8080/ligbuilder3/)。
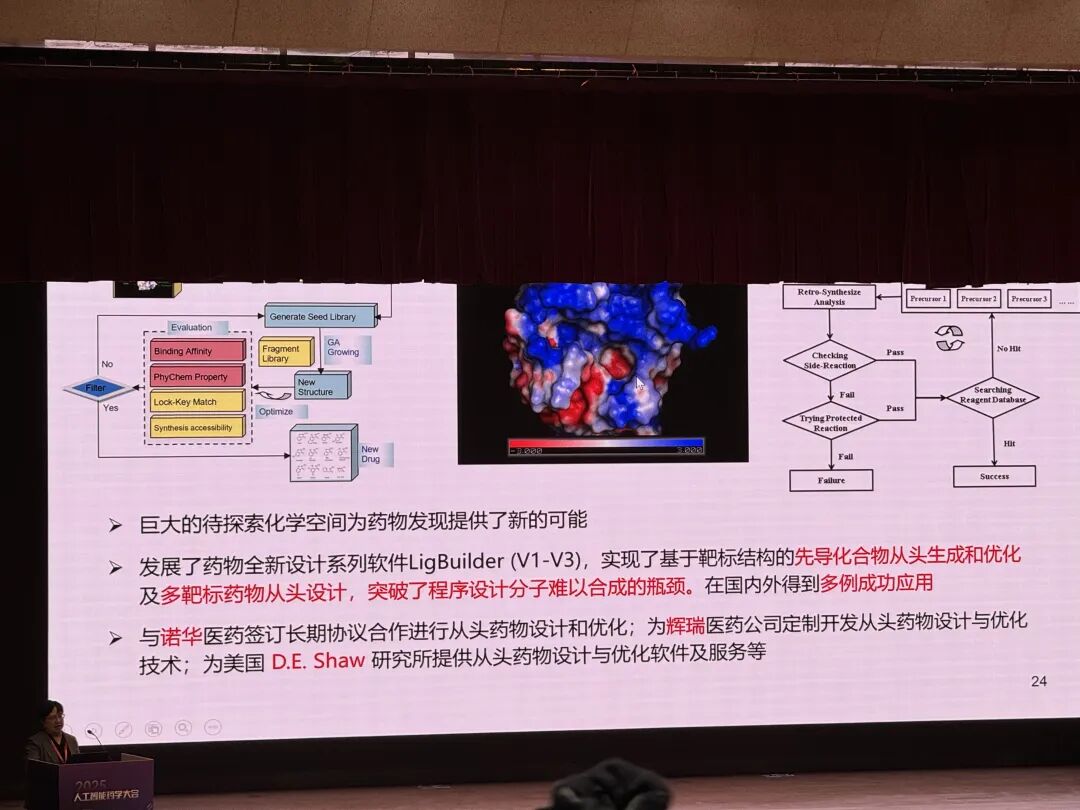
Yuan, Yaxia et al. "LigBuilder V3: A Multi-Target de novo Drug Design Approach." Frontiers in chemistry vol. 8 142. 28 Feb. 2020, doi:10.3389/fchem.2020.00142
Identification of gut microbial bile acid metabolic enzymes via an AI-assisted pipeline
该文发表在国际顶刊《Cell》,提出了一种人工智能(AI)辅助工具------胆汁酸酶宣告单元工具(BEAUT),预测了超过60万种候选胆汁酸(BA)代谢酶,构建了可公开访问的 HGBME 数据库,(https://beaut.bjmu.edu.cn)。BEAUT 是一款基于序列的胆汁酸代谢酶二分类模型,核心架构由 "特征提取层 + 分类层" 组成,以蛋白质语言模型 ESM2 为基础,基于 Transformer 架构的深度神经网络,从宏基因组数据中筛选胆汁酸代谢酶候选序列。通过实验验了证肠道微生物中存在两类关键新酶------单酸酰化胆汁酸水解酶(MABH)和 3-乙酰脱氧胆酸合成酶(ADS),证明微生物对胆汁酸的修饰不仅限于功能基团(羟基、羧基等),还存在碳骨架层面的创新修饰。

Ding Y, Luo X, Guo J, et al. Identification of gut microbial bile acid metabolic enzymes via an AI-assisted pipeline[J]. Cell, 2025, 188(21): 6012-6027. e20.
Accelerating discovery of bioactive ligands with pharmacophore-informed generative models
发表于《Nature Communications》,提出 pharmacophore 引导的生成模型 TransPharmer,其整合基于配体的可解释药效团指纹与生成式预训练 Transformer(GPT)框架,可实现无约束分布学习、从头分子生成及药效团约束下的骨架拓展,尤其擅长骨架跃迁以产生结构独特但药学相关的化合物;通过多巴胺受体 D2(DRD2)和 polo 样激酶 1(PLK1)相关案例验证其有效性,其中针对 PLK1 合成的 4 个化合物中 3 个具有亚微摩尔活性,最优化合物 IIP0943 potency 达 5.1 nM,拥有新型 4-(苯并 [b] 噻吩 - 7 - 基氧基) 嘧啶骨架,兼具高 PLK1 选择性及对 HCT116 细胞增殖的亚微摩尔抑制活性,为发现结构新颖且具生物活性的配体提供了有力工具。
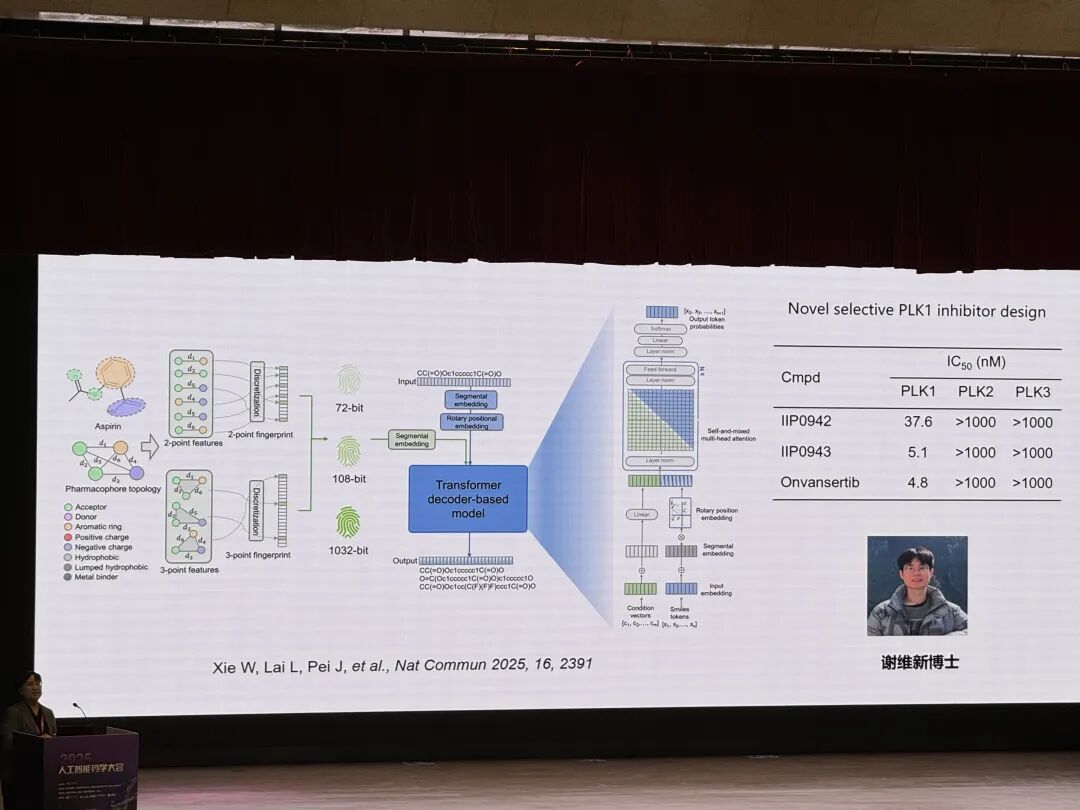
Xie W, Zhang J, Xie Q, et al. Accelerating discovery of bioactive ligands with pharmacophore-informed generative models[J]. Nature communications, 2025, 16(1): 2391.
Benchmarking Cofolding Methods for Molecular Glue Ternary Structure Prediction
发表在《Journal of Chemical Information and Modeling》,构建了含 221 个实验结构的分子胶三元复合物数据集 MG-PDB 及独立基准测试集 MGBench(含 88 个 2021 年后发布的无数据泄露结构),对 AlphaFold 3 等五种主流 AI 共折叠模型进行系统性评测,发现 AlphaFold 3 表现最佳,其蛋白质 - 蛋白质相互作用界面和分子胶 - 蛋白质相互作用预测成功率分别达 50.6% 和 32.9%,但所有模型均存在泛化能力不足、对大相互作用界面及分子胶降解剂复合物预测准确性低、依赖训练集相似结构 "记忆" 等问题,且在新型 E3 连接酶相关复合物预测中完全失败,该研究建立的标准数据集与测试集为分子胶结构预测算法开发提供了关键资源,也为后续模型改进指明了方向。

Liao Y, Zhu J, Xie J, et al. Benchmarking cofolding methods for molecular glue ternary structure prediction[J]. Journal of Chemical Information and Modeling, 2025.
Computer-Aided Drug Discovery for Undruggable Targets
《Chemical Reviews》发表综述,总结了物理模型与人工智能驱动的计算机辅助方法在 "不可药" 靶标小分子药物发现中的最新进展,将 "不可药" 靶标分为缺乏配体结合口袋、活性位点保守、天然无序蛋白、蛋白 - 蛋白相互作用或大组装体界面、需激活的疾病抑制蛋白五类,重点聚焦靶向无序蛋白、别构位点、蛋白 - 蛋白相互作用及蛋白降解四大方向,梳理了相关策略、成功案例与核心挑战,强调计算与 AI 技术在靶标识别、动态结构预测、虚拟筛选、分子生成等环节的关键作用,指出 "不可药" 正从 "难以药物化" 向 "有待药物化" 转变。同时展望未来,提出需构建靶标特异性化合物库、发展 AI 分子生成模型、结合高通量实验,以及探索蛋白质 / 多肽设计等方向,推动多数 "不可药" 靶标转化为可药靶标,为疾病治疗提供新机会。
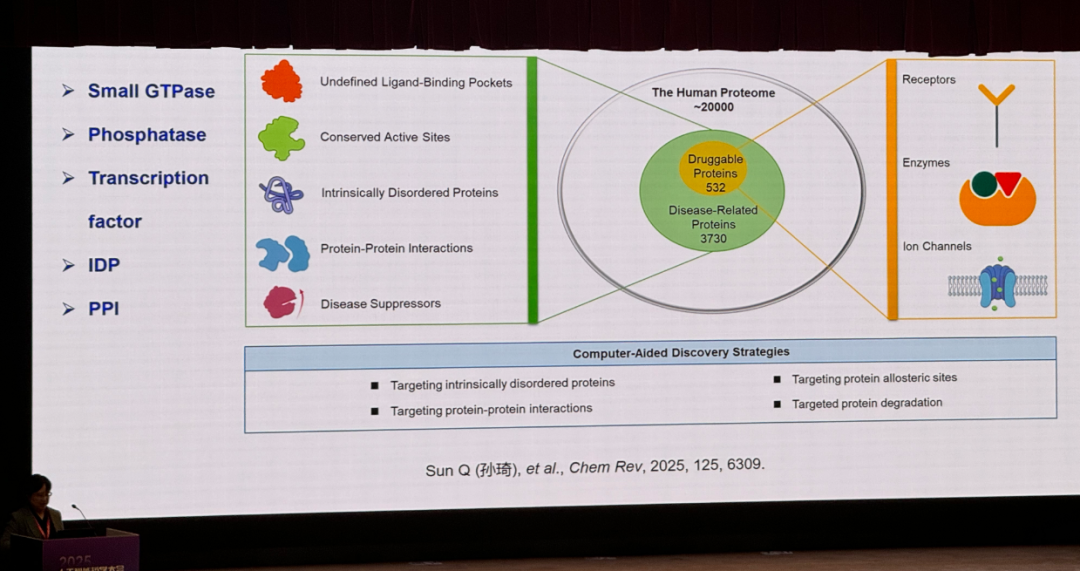
Sun Q, Wang H, Xie J, et al. Computer-Aided Drug Discovery for Undruggable Targets[J]. Chemical Reviews, 2025.
分会一:药物智能设计与优化(生物大分子)
A kinetic gatekeeper: TCR-pMHC dissociation dynamics determine T cell activation efficacy
深圳理工大学张增辉带来的蛋白-蛋白相互作用及TCR-pMHC解离动力学对T细胞激化的关键影响,主要讨论了小分子药物筛选、TCR免疫治疗以及治疗性疫苗开发的最新研究进展。此外还分享了部分实验数据、计算模拟方法以及在抗结核和抗病毒领域的潜在应用。提出了一种能够有效抑制细胞生长的分子药物,并计划进一步开发为抗TB药物,但目前该分子已申请专利,未公开这部分的工作。感兴趣的同学可以参考https://doi.org/10.1002/pro.70346这篇文章

Yan M, Wang J, Zhang J Z H. A kinetic gatekeeper: TCR‐pMHC dissociation dynamics determine T cell activation efficacy[J]. Protein Science, 2025, 34(11): e70346.
人工智能驱动的抗体药物研发
复旦大学应天雷带来的关于人工智能驱动抗体药物研发的研讨会,主要围绕了抗体药物的发展与作用机制、抗体药物的创新与设计、人工智能在抗体药物研发中的应用以及临床进展与成果这四个方面开展。结束后我查了一下他们的工作,其中最让我感兴趣的是"A Generative Foundation Model for Antibody Design"这一篇文章。提出了一种多功能抗体生成基础模型IgGM。该模型整合预训练蛋白质语言模型(PPSM)、Sgformer 特征编码器和预测模块,同时学习抗原-抗体结合规律与抗体序列-结构映射关系。覆盖六大抗体设计场景:抗原 - 抗体复合物结构预测、抗体逆设计、抗体框架区设计、抗体亲和力成熟、抗体从头设计、纳米抗体设计。该模型的意义在于首次实现抗体设计多任务统一,无需模板即可生成高活性抗体,为肿瘤免疫、抗病毒等领域的抗体开发提供高效工具。感兴趣的同学可参考(https://doi.org/10.1101/2025.09.12.675771)
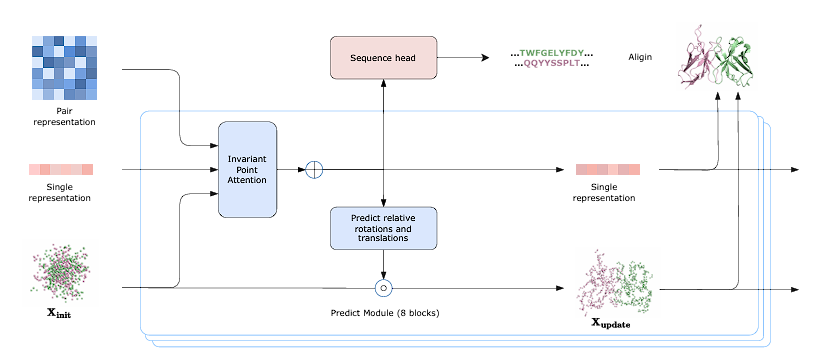
Wang R, Wu F, Shi J, et al. A generative foundation model for antibody design[J]. bioRxiv, 2025: 2025.09. 12.675771.
分会二:制药物靶点的智能发现与验证
Al Agent提速创新药进入IND阶段

智慧芽信息科技有限公司的胡玮介绍了其公司开发的一个ai agent平台,该平台可用于优化药物研发工作流,包括构效关系分析、专利自动化处理及临床数据预测等场景。鄙人也是第一此听到这个词,查阅资料后明白了原来就是一种具备自主感知、决策与执行能力的 AI 系统,说人话就是给ai装上小插件,也就是chatGPT几年前玩的东西,并不新鲜。值得注意的是提供了一个ai平台将多个生物医药专属的数据库赋予人工智能大脑,但是这个平台很多都是收费的,对于我们意义不大。工具的网址放在这里:https://home.zhihuiya.com/。
基于"天穹一号"科学计算的药物靶点发现及应用

上海思朗科技股份有限公司的贺明给我们介绍了他们公司自主研发的超算"天穹一号",主要就是介绍了他的发展历史、计算规模和速度以及计算机的硬件架构。
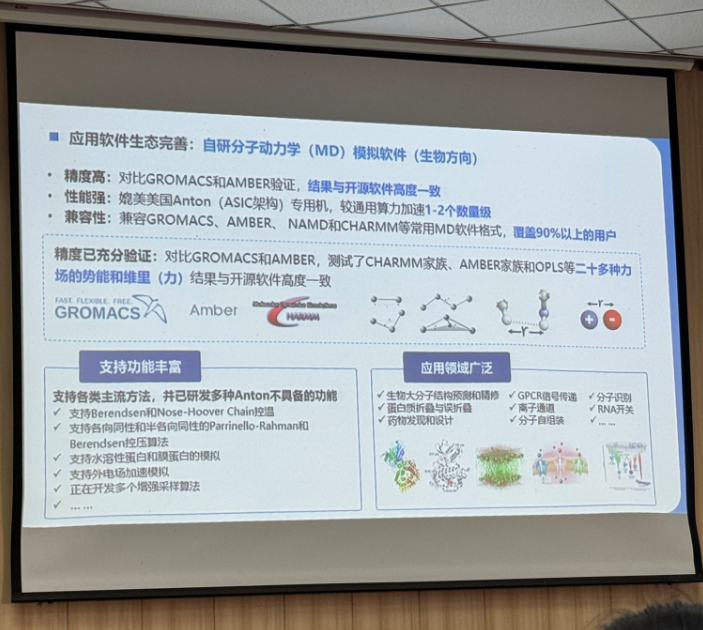
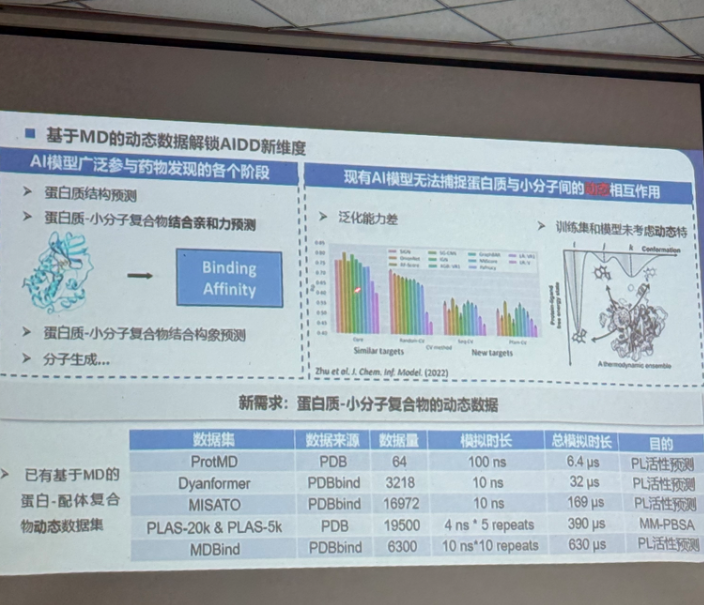
看到这里我不禁感慨国产芯片发展如此迅速, 从被 "卡脖子" 时的处处受限,到现在能够自主研发,这种逆袭背后是无数科研团队和企业的持续攻坚,在这里给他们点个大大的赞。不过话说回来,这种超规模的计算对于我们来说并没有需求,在这里可以考虑我们的计算服务。长期以来我们都在致力于提供足够支持你完成硕博生涯的生信环境,近期还新鲜上机了RTX5090、4080S、5070显卡。详细可点击https://mp.weixin.qq.com/s/fkQNWmOEAVjiqMd4vYoDIw了解。
结束语
最后如果也有其他同学也参与了此次会议,也非常欢迎大家和我们共同分享您的参会体验