
论文地址:
bash
https://link.springer.com/article/10.1007/s00330-023-10295-x文章目录
-
- 一、总结
- 二、研究背景与意义
-
- [2.1 颅内动脉瘤(IAs)的临床重要性](#2.1 颅内动脉瘤(IAs)的临床重要性)
- [2.2 现有自动检测方法的局限性](#2.2 现有自动检测方法的局限性)
- 三、研究动机与创新点
-
- [3.1 为何选择T1序列?](#3.1 为何选择T1序列?)
- [3.2 研究挑战](#3.2 研究挑战)
- 四、研究方法详解
-
- [4.1 数据集](#4.1 数据集)
- [4.2 图像预处理](#4.2 图像预处理)
- [4.3 网络框架](#4.3 网络框架)
- [4.4 训练细节](#4.4 训练细节)
- [4.5 后处理与统计分析](#4.5 后处理与统计分析)
- 五、实验结果
-
- [5.1 分割性能](#5.1 分割性能)
- [5.2 检测性能](#5.2 检测性能)
- [5.3 体积一致性](#5.3 体积一致性)
- 六、深入理解文献综述部分
-
- [6.1 临床问题](#6.1 临床问题)
- [6.2 现有技术的梳理](#6.2 现有技术的梳理)
- [6.3 可行性分析](#6.3 可行性分析)
一、总结
研究目标: 开发一个基于常规磁共振T1序列的深度学习框架,用于颅内动脉瘤(IAs)的自动分割(逐像素勾勒)与检测(定位),以填补临床空白。
核心发现: 该框架在T1序列上实现了与血管造影(CTA/MRA)相媲美的性能,证明了利用最普遍的MRI序列进行IA筛查的可行性,具有重大临床意义。
二、研究背景与意义
2.1 颅内动脉瘤(IAs)的临床重要性
- IAs是脑血管壁的异常膨出,全球约3%的人口患病。
- 破裂后会导致非外伤性蛛网膜下腔出血,致死率和致残率极高。
- 早期发现和干预至关重要,但目前依赖影像学检查(如DSA、CTA、MRA),存在放射性、创伤性、成本高等问题。
2.2 现有自动检测方法的局限性
论文综述部分对目前主流的IAs检测方法进行了详细梳理:
(1)基于DSA的方法
- 性能较好,但辐射剂量大、侵入性强,且有创检查,临床应用受限。
- 部分患者因先前诊断而未进行DSA检查,限制了该类算法的使用。
(2)基于数字减影血管造影(CTA)的方法
已有多种基于CNN的方法,如DeepMedic、ResNet-18等。同样存在问题:
- 敏感性与特异性难以兼顾;
- 分割Dice系数有待提升;
- CTA常用于破裂动脉瘤诊断,常规检查中不包含血管成像;
- 同样存在放射性问题。
(3)基于MRA的方法
- 非侵入性、无辐射,应用较CTA广泛。
- 已有研究使用DeepMedic、ResNet-18、3D CNN等方法。
但是存在以下问题:
- 敏感性与特异性仍有提升空间;
- MRA并非所有医院常规检查,存在漏扫风险;
- 已有研究表明MRA人工检测敏感性和准确性较高(>95%),算法提升空间有限。
三、研究动机与创新点
3.1 为何选择T1序列?
- T1序列是临床常规MRI序列,几乎每位患者都会接受该检查。
- 目前尚无基于T1的IAs自动检测与分割方法。
- 许多患者因无症状未进行血管成像检查(CTA/MRA/DSA),导致IAs被漏诊。
- 若能基于T1序列自动检测和分割IAs,可实现早期筛查,尤其在资源匮乏地区具有重要意义。
3.2 研究挑战
- T1序列中IAs与背景强度重叠严重,对比度低;
- IAs形态、大小多样;
- 分割任务难度大,需要高精度voxel-level标注。
四、研究方法详解
4.1 数据集
北京天坛医院,2015-2021年确诊患者。只包含囊状动脉瘤(最常见类型),排除其他复杂类型。共计 136名患者,159个IAs(>20 mm³)。
取127个用于训练/验证,32个用于测试。另外, 从公开数据集OpenNeuro获取31例无IAs的T1图像,用于评估模型在健康人中的假阳性率。
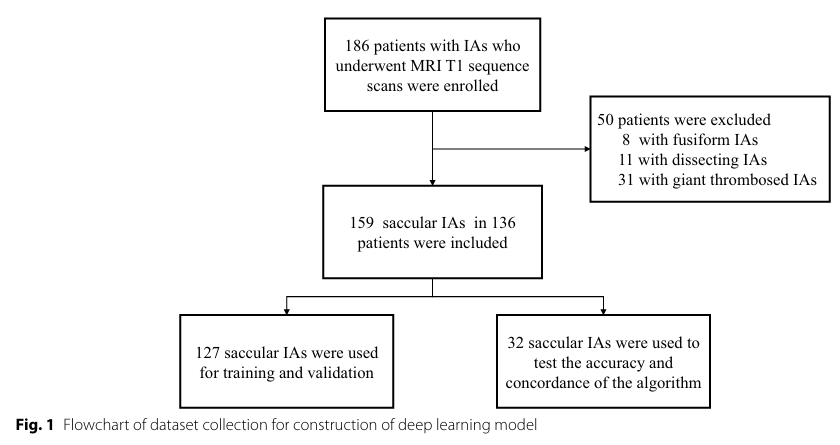
上图清晰展示了从186名患者筛选到最终159个IAs的过程。
数据集的标注者为20年经验的神经放射科专家。使用ITK-SNAP进行标注( 体素级(voxel-wise),为分割任务提供"金标准"),然后神经外科团队二次审核,确保标签质量。
4.2 图像预处理
训练阶段(核心是提取高质量的训练样本块):
- 强度截断(0-2000): 增强图像对比度,突出感兴趣区域。
- 自适应ROI提取: 这是关键创新点之一。初始使用最小边界立方体(MBC)会导致动脉瘤被切掉一部分,丢失语义信息。作者设计了一个自适应算法,确保提取出的3D图像块(80x128x128)能完整包含整个动脉瘤。
- 选择性使用3D CLAHE: 仅对第三个模型使用这种对比度增强技术,以专门处理低对比度动脉瘤。
- 归一化(Z-score)与数据增强: 使用Z-score标准化数据;通过随机翻转、旋转等增加数据多样性,防止模型过拟合。
测试阶段(目标是处理整幅图像):
- 裁剪: 去除背景和头骨(动脉瘤不会长在那里),减少计算量。
- 深度调整: 调整图像深度使其能被16整除,以便网络能直接处理全序列,而无需使用低效的滑动窗口法。
- 分数据归一化: 对测试集单独归一化,防止数据泄露(data leakage)。
- 后处理: 移除小体积区域(<5 mm³)以降低假阳性。
- 模型集成: 使用集成算法融合三个模型的预测结果。
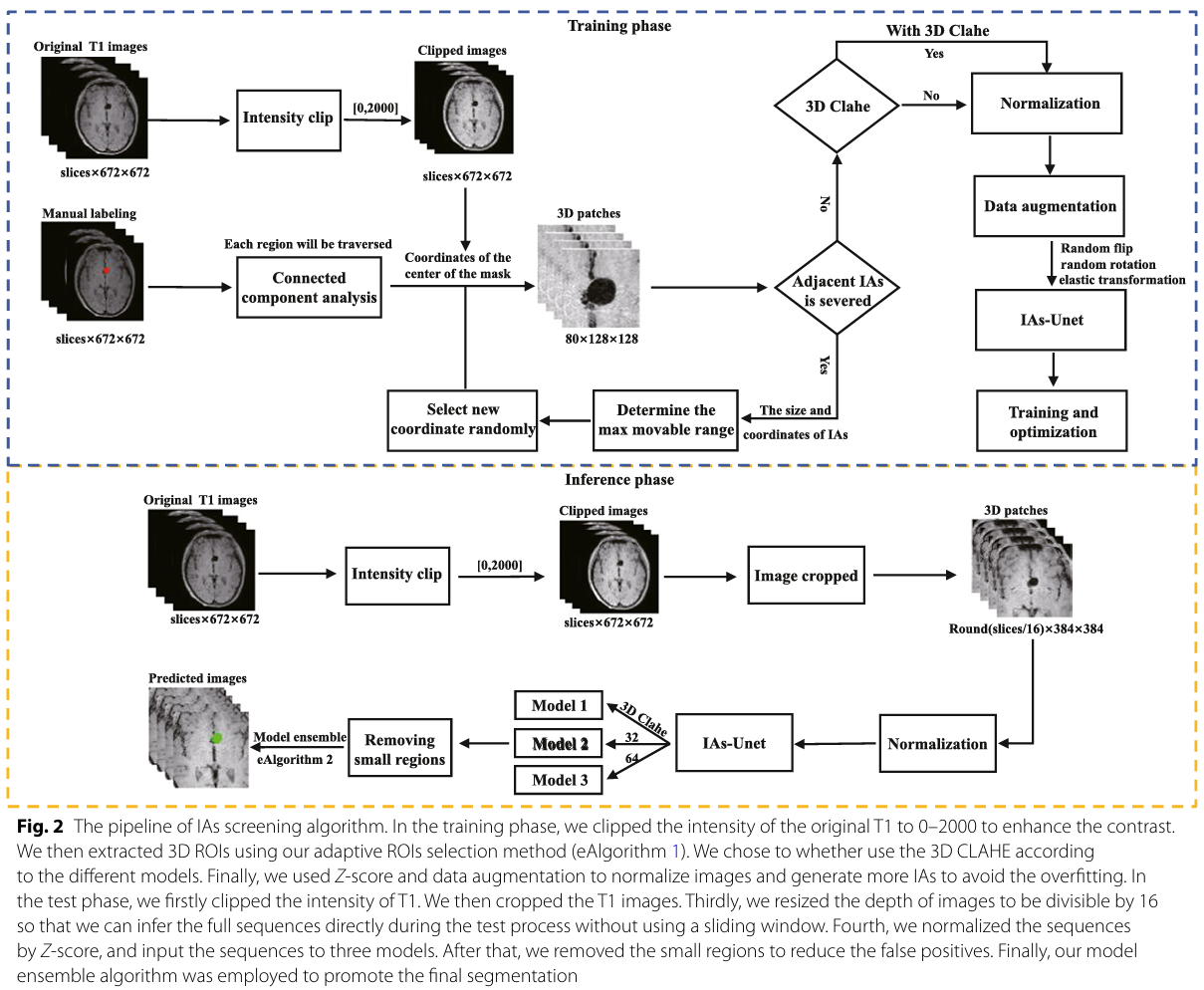
4.3 网络框架
网络核心架构:IAs-Unet。如下图所示:
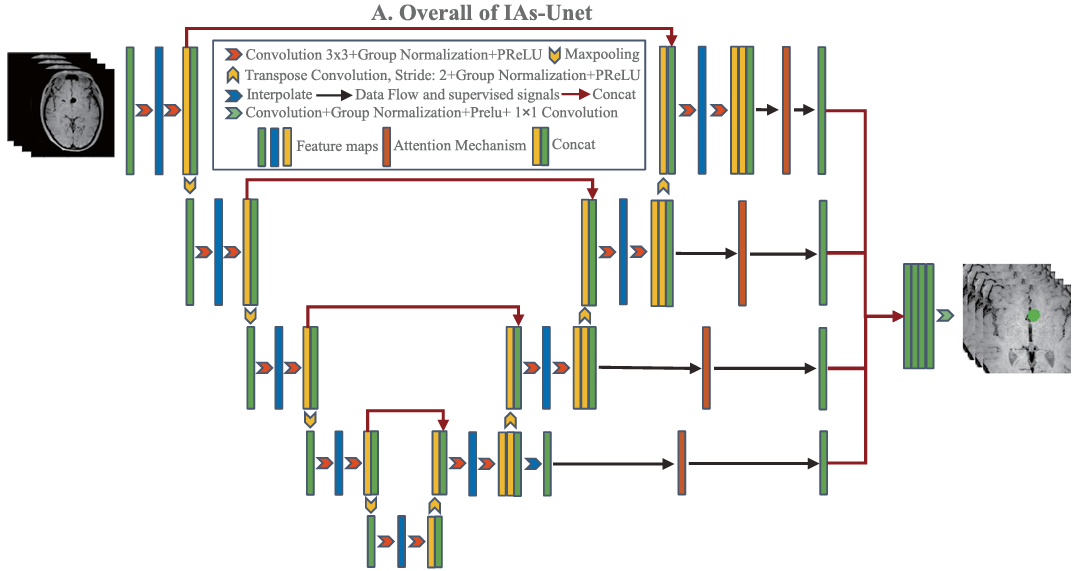
- 基础: 3D U-Net。
- 组归一化(Group Norm)+ PReLU: 替代传统的批归一化和ReLU,更适合小批量训练,并提升非线性表达能力。
- 残差连接(Residual Connections): 缓解深度网络中的梯度消失问题。作者将残差块中的相加(addition)改为拼接(concatenation),以保留更多特征。
- 注意力机制(Attention Mechanism): 引入多尺度注意力模块(参考Dou等人工作《 A deep attentive convolutional neu
ral network for automatic cortical plate segmentation in fetal MRI.》),让网络能聚焦于动脉瘤区域。 - 深度监督(Deep Supervision): 在解码器的中间层也加入损失函数,帮助梯度回传,优化训练。
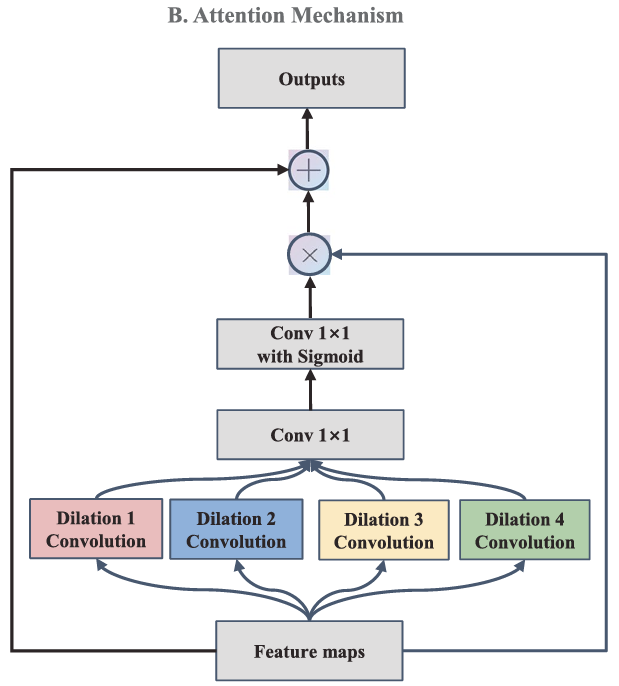
文章作者建立了三个不同的模型去集成:
- Model 1: 基础模型,32个初始卷积核。
- Model 2: "大而全"模型,64个初始卷积核,提取更复杂特征,但易产生假阳性。
- Model 3: "增强版"模型,32个初始卷积核,但输入数据经过3D CLAHE预处理,专攻低对比度动脉瘤。
4.4 训练细节
- 显卡:Nvidia Quardo RTX 8000 with 48 GB or Nvidia GeForce RTX3090 with 24 GB
- 优化器: Adam,初始学习率0.0001。
- 损失函数: Dice Loss。
- 动态学习率: 验证集指标30轮不提升,则学习率降为原来的0.1倍。
- 训练轮数: 三个模型分别为310, 450, 150轮。
4.5 后处理与统计分析
- 后处理: 连通域分析 + 小体积过滤 + 模型集成算法。
评估指标:
- 分割指标: Dice系数、敏感度、特异性、平衡准确率、AUC、Kappa系数等。
- 检测指标: 在不同重合率阈值下计算敏感度和假阳性数。重合率 > 0.7 定义为真阳性(这是一个比同类研究更严格的标准)。
- 体积一致性指标: 计算模型分割体积与专家标注体积的皮尔逊相关系数和一致性相关系数,并绘制Bland-Altman图。
五、实验结果
5.1 分割性能
- Dice系数:0.80(平均),0.87(中位数)。中位数更高说明大部分样本分割效果很好,少数困难样本拉低了均值。
- 体素级指标全面优异: 敏感度0.87,特异性高达0.9998,平衡准确率0.94。这表明模型既能找到大部分动脉瘤组织,又几乎不会把正常组织误判为动脉瘤。
- 定性对比:可视化显示模型分割结果(红色)与专家标注(蓝色)重合度(紫色)很高。
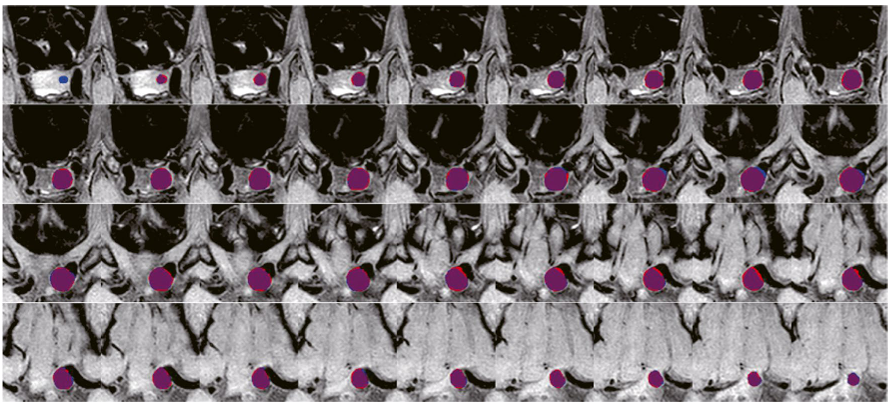
5.2 检测性能
- 在严格标准下(重合率>0.7):敏感度90.63%,每例假阳性0.58个。
- 重合率分布:大部分动脉瘤的重合率>0.7,说明模型预测区域与真实区域高度重叠。
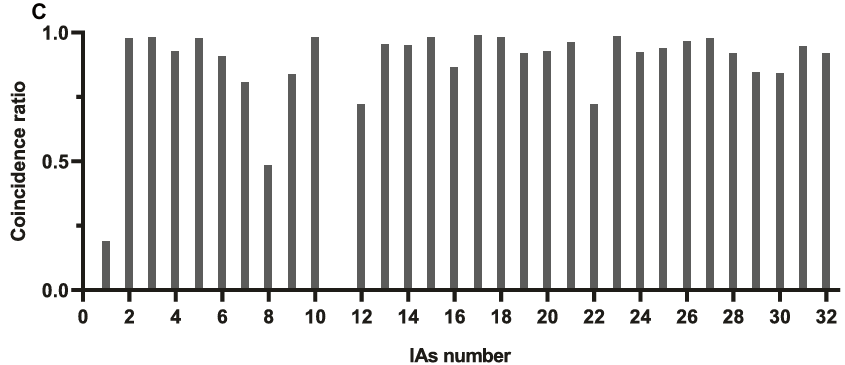
- 阴性样本假阳性: 4.4个/例。作者解释这是因为阴性样本的视野(FOV)更大,包含更多类似组织。
5.3 体积一致性
- 动脉瘤级别:体积相关性极强(Pearson = 0.9971),Bland-Altman图显示仅1个点超出95%一致性界限。
- 患者级别:相关性同样极高(Pearson = 0.991),仅2个点超出界限。
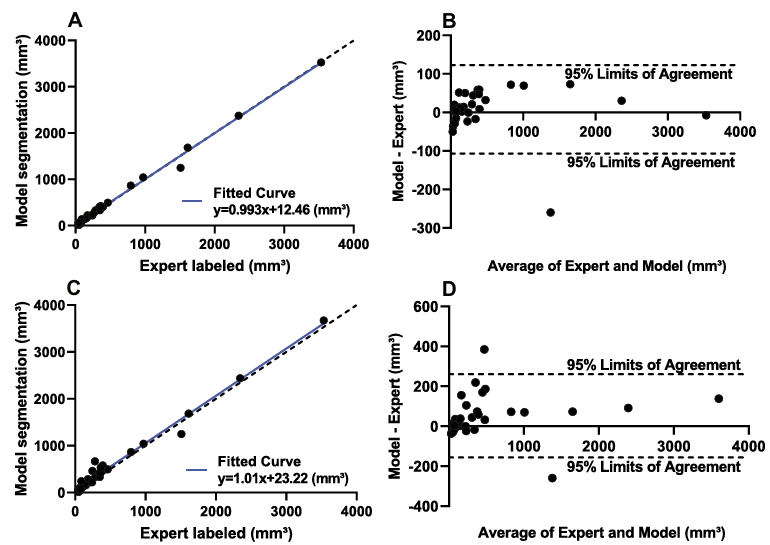
综上所述:模型不仅能定位动脉瘤,还能高精度地量化其体积,这对于临床随访(观察动脉瘤是否增大)至关重要。
六、深入理解文献综述部分
6.1 临床问题
-
背景: IAs是脑血管的"鼓包",全球患病率约3%。其破裂是致死致残率极高的蛛网膜下腔出血的主要原因。
-
临床痛点:
-
诊断依赖性强: IAs的定位高度依赖经验丰富的放射科医生,过程耗时、主观。
-
精细分析需求: 为了评估动脉瘤稳定性或进行血流动力学模拟,需要进行体素级(voxel-wise)标注,这极其费时费力。
-
研究愿景: 开发计算机辅助诊断系统,可以:
-
在资源有限的医院实现早期筛查。
-
将专家从繁重的标注工作中解放出来,专注于制定治疗方案。
6.2 现有技术的梳理
作者将现有基于影像的自动检测方法分为三类,并逐一分析其优缺点,为引出自己的研究做铺垫。
(1)基于DSA(数字减影血管造影)的方法:
-
优势: 性能通常最好(金标准)。
-
致命缺点:
-
有创且辐射大: 是侵入性检查,辐射剂量高。
-
应用场景受限: 通常用于确诊或治疗前,不用于初次筛查。如果病人之前没做过DSA,这类算法就无用武之地。
-
结论: 不适合作为普筛工具。
(2)基于CTA(CT血管成像)的方法:
- 研究现状: 列举了Shahzad(DeepMedic, Dice 0.8)、Yang(ResNet-18, 敏感度97.5%但假阳性高)、Meng(多模态CNN, Dice 0.705)等人的工作。
- 性能瓶颈: 难以同时保持高敏感度(找到所有真阳性)和高特异性(排除所有假阳性)。这是一个权衡(trade-off)。
- 临床定位矛盾: CTA常用于诊断已破裂的动脉瘤,此时临床重点是紧急救治。对于未破裂的IAs,由于CTA有辐射,并非常规体检或非特异性头痛患者的首选检查。
- 人工诊断已足够好: 文献指出,在无出血等干扰情况下,人工读CTA片的敏感度可达77-97%。这意味着算法提升的边际效益有限。
结论: CTA本身有辐射,且在其主攻的领域(破裂动脉瘤诊断)中,算法的临床迫切性并不高。
(3)基于MRA(磁共振血管成像)的方法:
- 优势: 无创、无辐射,比CTA更常用。
- 研究现状: 列举了Sichtermann(DeepMedic)、Daiju(ResNet-18)、Joo(3D CNN)等人的工作。
- 同样存在敏感度-特异性权衡问题。
- "非必须检查"导致的漏诊: 这是作者提出的一个关键洞见。尽管MRA对IAs显示清晰(人工敏感度>95%),但问题在于------很多患者根本就不会去做MRA检查。如果患者因头痛做常规MRI(通常只包含T1、T2序列),医生经验不足可能漏诊,也不会特意加扫MRA,从而错过发现IAs的机会。
- 结论: MRA本身性能好,但可及性(availability) 是最大问题。算法无法解决"没做这个检查"的根本性漏诊。
6.3 可行性分析
- 理论区分: 指出自动方法可分为块状检测(patch-wise)和体素分割(voxel-wise)。后者能提供动脉瘤的完整形态,对后续的血流模拟和稳定性评估更有意义。
- 核心临床洞察: IAs起病隐匿,早期无症状。这类患者通常不会接受CTA/MRA/DSA这些专门的血管检查。
- 提出"杀手级应用"场景: 对于经验不足的医生,在常规检查(如平扫CT/MRI) 上识别潜在IAs非常困难。因此,开发一个能用于最常规的MRI序列------T1的模型,具有巨大的临床价值。
- 承认技术挑战: 在T1序列上,IAs与背景强度重叠,对比度低,形态多变,分割难度极大。
- 提出假设: 深度学习(如3D CNN)能提取复杂特征,或许能攻克这个难题。