Identification of VvOMTs Gene Families and Functional Analysis of Promoters in Wine Grapes
茶树(山茶属)CCoAOMT基因家族的全基因组鉴定、表达分析和蛋白质相互作用分析-全基因组家族分析-文献精读13-CSDN博客
两种参与茶树O-甲基化儿茶素生物合成的O-甲基转移酶的特征分析-文献精读20_characterization of two o-methyltransferases invol-CSDN博客
N-甲基转移酶晶体-文献精读115_cyanogramide-CSDN博客
咖啡基因组揭示咖啡因生物合成的趋同进化机制--文献精读152_咖啡族 139个物种的系统发育分析-CSDN博客

摘要
目的 鉴定葡萄(Vitis vinifera L.)VvOMTs 基因家族启动子对激素和干旱信号的响应,阐明VvOMTs 基因家族的启动子功能,为干旱条件下VvOMTs 调控3-烷基-2-甲氧基吡嗪香气物质合成提供理论依据。 方法 采用生物信息学方法分析其蛋白理化性质、染色体定位、基因结构和启动子顺式作用元件;通过农杆菌介导的烟草瞬时转化体系验证VvOMT2 和VvOMT3 基因启动子对脱落酸(abscisic acid, ABA)、茉莉酸酸甲酯(methyl jasmonate, MeJA)和甘露醇的响应。 结果 葡萄VvOMTs 基因家族编码序列CDS区介于1 062‒1 110 bp,蛋白氨基酸数介于353‒369 aa;4个VvOMTs 在葡萄第3和第12号染色体上均匀分布;亚细胞定位预测结果表明,VvOMTs蛋白存在于细胞质;启动子顺式作用元件分析表明,VvOMTs 基因可能受到光照、多种植物激素和干旱胁迫的诱导;瞬时转化本氏烟草GUS染色、GUS 基因定量和酶活活性测定结果表明,在ABA、MeJA和甘露醇的诱导下,转化VvOMT2 和VvOMT3 启动子的烟草叶片均呈现蓝色反应;VvOMT2 和VvOMT3 的GUS 基因表达水平呈现先升高后下降趋势,且显著上调16.80和77.73倍、14.09和34.15倍、30.77和36.40倍;VvOMT2 和VvOMT3 的GUS酶活性在ABA和MeJA处理下呈先升高后下降,且显著上调16.62和21.69倍、4.50和3.00倍,甘露醇处理下出现"双峰"变化趋势,显著上调15.13和18.64倍。 结论 从葡萄基因组中共鉴定出4个调控甲氧基吡嗪合成的甲氧基转移酶基因(VvOMT1-4 ),VvOMT2 和VvOMT3基因启动子参与干旱、ABA和MeJA响应,并受其调控。
3-烷基-2-甲氧基吡嗪(3-alkyl-2-methoxypyrazines, MPs)是一类挥发性含氮杂环化合物,广泛分布于植物、昆虫、真菌和细菌中[1]。在植物中,MPs赋予多种新鲜蔬菜(如豌豆、芦笋、生菜和马铃薯等)泥土风味,而在葡萄酒中,其赋予红葡萄酒"生青"味[2]。目前,葡萄和葡萄酒中共检测到7种MPs,其中,3-异丁基-2-甲氧基吡嗪(3-isobutyl-2-methoxypyrazine, IBMP)、3-异丙基-2-甲氧基吡嗪(3-isopropyl-2-methoxypyrazine, IPMP)和3-仲丁基-2-甲氧基吡嗪(3-sec-butyl-2-methoxypyrazine, SBMP)被认为是影响葡萄酒风味的主要MPs[2]。
MPs生物合成是由2个氨基酸分子直接缩合成环,在甲氧基转移酶(O -methyltransferase, OMTs)作用下,将非挥发性的2-羟基-3-烷基吡啶(2-hydroxy-3-alkylpyrazine, HPs)转化为MPs。迄今为止,已经从'赤霞珠'(Cabernet Sauvignon L.)[3]、'美乐'(Merlot L.)[4]、'品丽珠'(Cabernet Franc L.)[5]、'长相思'(Sauvignon Blanc L.)[6]和'马瑟兰'(Marselan L.)[7]等葡萄品种中鉴定出VvOMTs 基因,其中,VvOMT2 和VvOMT3 被证明是葡萄果实中合成IBMP和3-异丁基-2-羟基吡嗪(3-isobutyl-2-hydroxypyrazine, IBHP)的关键基因[7]。因此,研究VvOMTs基因家族结构和功能对MPs的生物合成至关重要。
OMT 基因家族在植株生长发育和次生代谢物合成中发挥重要作用。例如,拟南芥(Arabidopsis thaliana )AtOMT1 参与植物花粉发育和果荚生长[8];紫玉兰(Magnolia liliifllora )MlOMT1 在盛花期表达最高,促进花青素合成并参与其甲基化修饰[9];柑橘(Citrus reticulata )CreOMT13 竞争甲氧基黄酮(PMFs)支路的底物,显著增加橙皮苷含量[10];连翘(Forsythia suspensa )FsOMT 和FsCCoAOMT 分别参与表松脂酚和咖啡酸合成连翘脂素和阿魏酸[11];西瓜(Citrulus lanatus )ClCOMT1 基因过表达西瓜愈伤组织发现可显著提高褪黑素含量,并在干旱和低温等非生物胁迫抗性中发挥重要作用[12];牡丹(Paeonia suffruticosa )PsOMT1 在切花破绽期显著上调,与花青素积累趋势一致[13];葡萄VvOMT2 和VvOMT3稳定转化番茄和葡萄愈伤组织促进甲氧基吡嗪的积累[14]。
目前,关于葡萄果实MPs生物合成,仅围绕在干旱胁迫下MPs含量变化、VvOMTs 基因表达趋势、VvOMT2 和VvOMT3 基因功能验证层面进行研究[14],但VvOMTs基因家族启动子响应激素和干旱胁迫的上游调控等关键科学问题仍需开展深入的研究。
本研究基于葡萄全基因组水平对葡萄VvOMTs 基因家族成员进行鉴定,利用生物信息学方法分析VvOMTs家族蛋白理化性质和基因结构等特性,采用瞬时转化烟草叶片验证VvOMTs基因家族启动子对激素和干旱的响应,以此解析其启动子参与上游调控的分子机制和功能,为进一步开展葡萄MPs生物合成的基因研究及分子育种奠定基础。
1 材料与方法
1.1 材料
植物瞬时表达材料本氏烟草(Nicotiana tabacum cv*.* NC89)种子春化后播种于湿润的基质中(泥炭土∶蛭石∶珍珠岩,1∶1∶1,体积比),放置于人工智能气候培养箱(设定培养条件为温度22 ℃,湿度80%,16 h光照+8 h黑暗),选取培养4周的烟草叶片用于瞬时转化启动子GUS活性分析。
1.2 方法
1.2.1 葡萄VvOMTs家族基因的鉴定
酿酒葡萄VvOMTs家族基因的基因号、CDS和氨基酸序列在NCBI(https://www.ncbi.nlm.nih.gov/)网站中获得。通过在线软件ProtParam(https://web.expasy.org/compute_pi/)计算获取蛋白分子量和等电点。蛋白亚细胞定位通过WoLFPsort(https://wolfpsort.hgc.jp/)预测。
1.2.2 葡萄VvOMTs家族基因在染色体上的分布与基因结构
通过Ensemblplants网站(https://plants.ensembl.org/)中Blast-Search分析VvOMTs家族成员的染色体数据。从NCBI和UCSC网站(https://hgdownload.soe.ucsc.edu/hubs/plants/)获取染色体位置及长度,利用MG2Cv.2(http://mg2c.iask.in/mg2c_v2.1/)软件进行染色体物理定位图的绘制。
1.2.3 葡萄VvOMTs家族基因启动子序列分析
获取VvOMTs 基因家族成员的起始密码子ATG上游1 500 bp的序列为基因启动子,提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库,对葡萄VvOMTs家族基因启动子序列进行顺式作用元件的类型和数量分析,将结果用TBtools软件可视化。
1.2.4 启动子克隆、载体构建及农杆菌转化
以'马瑟兰'葡萄叶片gDNA为模板,分别用pC2301-ProVvOMT2 -F/R和pC2301-ProVvOMT3 -F/R进行SeqAmp DNA Polymerase PCR扩增(表1)。PCR反应程序为:94 ℃ 1 min;98 ℃ 10 s,55 ℃ 15 s,68 ℃ 60 s,29个循环;68 ℃延伸5 min,保温于4 ℃,反应结束后进行琼脂糖凝胶电泳检测。将条带正确的PCR产物用试剂盒进行胶回收,连接于克隆载体pCAMBIA2301并转化至大肠杆菌DH5α中,37 ℃倒置培养12 h,挑取单菌落进行PCR鉴定并送至公司进行测序。序列比对成功的表达载体电击转化至农杆菌EHA105(电击转化参数:V=1 800 V,R=200 Ω,C=25 F)后,平板置于28 ℃倒置培养2‒3 d[15]。
表1 葡萄VvOMTs家族基因扩增和RT-qPCR引物序列
Table 1 Amplification and RT-qPCR primer sequences for grape (Vitis vinifera L.) VvOMTs family genes
| 基因名称 Gene name | 上游引物序列 Forward primer (5′-3′) | 下游引物序列 Reverse primer (5′-3′) |
|---|---|---|
| pC2301-ProVvOMT2 | gctatgaccatgattacgaattcGACACAAATTAAGATGCCGG | atggggtcgactctagaggatcccatTTTCTGCTTCTCTCTTATGGAG |
| pC2301-ProVvOMT3 | gctatgaccatgattacgaattcGGCCCTATACAAATTGCCCAG | atggggtcgactctagaggatcccatCAATGGCACACTTCACTACAG |
| RT-GUS | GCTCTACACCACGCCGAACA | CCACCACCTGCCAGTCAACA |
| RT-Ntactin | TTGCCTGATGGACAAGTTATTACC | TAGGAGCCAAAGCCGTGATT |
注:小写字母为pC2301载体同源臂
1.2.5 瞬时转化烟草叶片
取转化pC2301-ProVvOMT2 和pC2301-ProVvOMT3单克隆农杆菌落接种于添加抗生素的液体LB培养基,28 ℃ 180 r/min进行活化培养(菌液OD600=0.5‒0.6)。室温下5 000 r/min离心10 min集菌,用重悬液调菌液OD600=0.1‒0.2,黑暗静置3 h后注射烟草叶片。2 d后分别喷施甘露醇(300 mmol/L)、ABA(100 μmol/L)和MeJA(100 μmol/L)溶液[16]。每处理喷施3株,3个生物学重复,共9株。在处理后0、3、6、9、12、24 h分别对叶片取样,用液氮速冻保存于-80 ℃用于后续实验,同时取烟草叶片进行GUS组织化学染色。
1.2.6 烟草叶片组织化学GUS染色
将烟草叶片放置于培养皿中,倒入GUS染液浸没,置于37 ℃培养箱中24 h,之后加入75%乙醇,放置于37 ℃培养箱过夜直至叶片完全脱色,将脱色叶片浸入纯水中软化并拍照记录表型。GUS染色液配置:1 L ddH2O中加入5.52 g NaH2PO4、14.19 g Na2HPO4、0.21 g K4Fe(CN)6、3.72 g EDTA和1 mL 1% Triton-X,混匀后加入260 mg GUS显色底物X-Gluc。
1.2.7 GUS蛋白含量测定
取烟草叶片0.1 g在液氮中充分研磨,加入1 mL GUS提取缓冲液(50 mmol/L磷酸钠,10 mmol/L EDTA,0.1% Triton X-100,0.1%十二烷基肌氨酸钠,10 mmol/L β-巯基乙醇),涡旋混匀后,4 ℃,5 000 r/min离心10 min。收集上清液,置于-80 ℃冰箱备用。蛋白含量测定采用Bradford法[17],取烟草叶片的GUS提取液20 μL,加入ddH2O 3 980 μL、考马斯亮蓝溶液1 mL,混匀,测定595 nm吸光值,根据标准回归方程计算样品中蛋白含量。
1.2.8 GUS蛋白酶活测定
取50 μL上述GUS蛋白提取液,加入500 μL反应缓冲液(用GUS提取缓冲液配置的1 mmol/L的4-甲基伞形酮-β-D葡萄糖苷,4-MUG)混合后于37 ℃预热10 min;随后吸取100 μL并加入900 μL反应终止液(0.2 mol/L Na2CO3)于37 ℃水浴中反应30 min用于荧光测定。GUS酶活测定方法参照Jefferson[16],样品荧光测定以0时样品为空白,在激发光365 nm,发射光455 nm,狭缝10 nm下测定样品的荧光强度,根据标准曲线计算样品中4-MU含量。GUS酶活活性计算:以每mg蛋白的酶活力来计算,结果表示成4-MU nmol/(min·mg)Protein。
1.2.9 GUS基因RT-qPCR分析
烟草叶片总RNA提取用RNAprep Pure 多糖多酚植物总RNA提取试剂盒流程进行操作;以总RNA为模板,参照PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒说明书进行反转录;选取Ntactin 为内参,引物由生工生物工程(上海)有限公司合成(表1)。RT-qPCR反应体系为20 μL:cDNA(200 ng/μL)1 μL,上下游引物各0.4 μL,2×Perfecstar 10 μL,ddH2O 8.2 μL;RT-qPCR扩增程序为94 ℃ 2 min;94 ℃ 10 s,60 ℃ 30 s,2‒3步循环40次。每个模板设3次生物学重复,取其平均值,目的基因的相对表达量用2-ΔΔCt计算[14]。
1.2.10 数据处理与分析
数据采用Excel 2019软件进行分析,柱形图用Origin 9.0(Origin Lab,MA,USA)和Paired Comparison Plot插件绘制,采用Fisher LSD检验分析差异显著性。
2 结果
2.1 葡萄VvOMTs家族成员鉴定及蛋白理化性质分析
从酿酒葡萄基因库中筛选鉴定到4个VvOMTs 家族基因,并根据染色体位置命名为VvOMT1 -4 (表2)。氨基酸理化性质分析表明,4个VvOMTs蛋白的氨基酸数量在353-369 aa,分子质量为38 595.60-40 835.11 kD,等电点为5.09-5.70,均小于7.0,说明VvOMTs是酸性氨基酸。亚细胞定位预测表明,VvOMTs蛋白均定位于细胞质(表2)。VvOMT1/2 和VvOMT3/4 分别均匀地分布在葡萄的第12和3号染色体上端(图1-A),且VvOMTs 基因均包括2个外显子和1个内含子(图1-B-E)。
表2 葡萄VvOMTs家族成员蛋白理化性质分析
Table 2 Analysis of physical and chemical properties of grape VvOMTs family member proteins
| 基因编号 Gene No. | 基因名称 Gene name | 编码序列 CDS sequence (bp) | 氨基酸数量 Number of amino acids (aa) | 分子质量 Molecular weight (kD) | 理论等电点 pI | 亚细胞定位Subcellular localization |
|---|---|---|---|---|---|---|
| KC533532.1 | VvOMT1 | 1 110 | 369 | 40 835.11 | 5.21 | 细胞质 |
| KC533540.1 | VvOMT2 | 1 104 | 367 | 40 312.59 | 5.53 | 细胞质 |
| KC243502.1 | VvOMT3 | 1 062 | 353 | 38 595.60 | 5.70 | 细胞质 |
| KC517476.1 | VvOMT4 | 1 080 | 359 | 39 263.11 | 5.09 | 细胞质 |
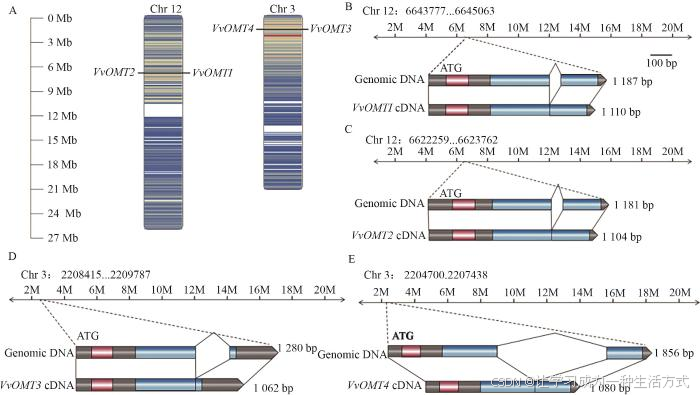
图1 VvOMTs家族成员染色体定位(A)和基因结构分析(B-E)
2.2 葡萄VvOMTs家族成员上游启动子序列及顺式作用元件分析
为预测VvOMTs 基因的潜在生物学功能,选取VvOMTs 基因上游1 500 bp的启动子区顺式作用元件进行分析发现,VvOMTs 上游元件主要分为植物生长发育响应、激素响应和逆境胁迫响应3种类型(图2)。其中,在VvOMT1 -4 基因启动子中均存在大量的光学响应元件(light responsive),参与植物昼夜控制(circadian control)和分生组织相关(meristem expression)响应元件。激素响应元件共预测到4种,其中茉莉酸甲酯(MeJA)响应元件最多(10个),脱落酸(abscisic acid)响应元件次之(8个),生长素(auxin)响应元件在VvOMT1、VvOMT2 和VvOMT4 基因启动子中存在,水杨酸(salicylic acid)响应元件在VvOMT1 -3 基因启动子中存在。逆境响应元件中主要包括参与厌氧诱导元件(anaerobic induction)。综上表明,VvOMTs基因在各种生理和生物学过程中具有调控作用。
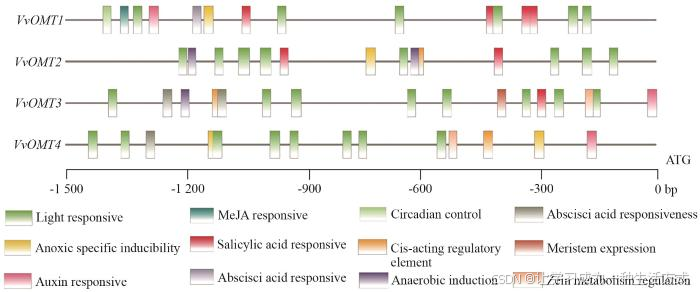
图2 葡萄VvOMTs家族成员上游启动子序列顺式作用元件分析
2.3 葡萄VvOMTs基因启动子对脱落酸的响应
对烟草叶片进行GUS染色,结果表明,转化空载体(阴性对照)的烟草叶片在喷施ABA 0‒24 h均未出现蓝色,转化CaMV 35S::GUS(阳性对照)的烟草叶片蓝色范围和强度最大,喷施ABA 3‒24 h后,VvOMT2 和VvOMT3 的启动子均对ABA有不同程度的显色反应,且蓝色强度低于CaMV 35S::GUS(图3-A)。通过对ABA处理下阴性对照、VvOMT2 和VvOMT3 的烟草叶片中GUS 基因进行定量,结果表明,转化VvOMT2 和VvOMT3 启动子的叶片在3‒24 h内GUS 基因相对表达量均显著高于阴性对照,分别在处理12 h和6 h时表达量最高,是对照的16.80倍和77.73倍(图3-B)。GUS蛋白酶活活性测定结果表明,转化VvOMT2 和VvOMT3 的烟草叶片中GUS酶活活性在ABA处理下均呈现先升高后降低趋势,同时在9 h达到最高,分别是对照的16.62倍和21.69倍(图3-C)。因此,在烟草瞬时转化体系中VvOMT2 和VvOMT3 基因启动子活性均会受到ABA的诱导表达,且VvOMT3响应更强烈。
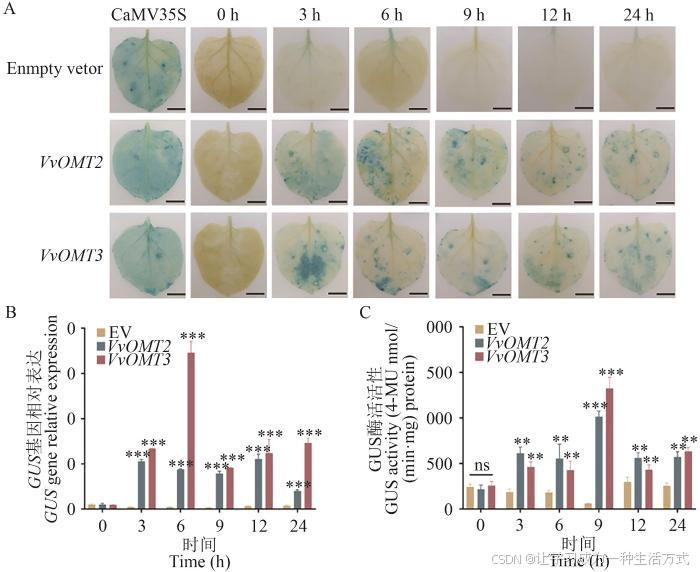
图3 '马瑟兰'葡萄VvOMTs基因启动子对ABA的响应
A:空载体、VvOMT2/3 基因启动子在ABA处理后烟草叶片的GUS染色,bar=1 cm;B:GUS 基因相对表达水平;C:GUS蛋白酶活活性。** P ≤0.01,*** P≤0.001,下同
2.4 葡萄VvOMTs基因启动子对甘露醇的响应
甘露醇是一种亲水性大分子,具有强吸水性,通过调节渗透势形成干旱胁迫。对烟草叶片进行GUS染色。结果表明(图4-A),VvOMT2/3 启动子在3‒24 h时均对甘露醇有不同程度的响应,空载体(阴性对照)未出现蓝色。通过对甘露醇处理下阴性对照、VvOMT2/3 的烟草叶片中GUS 基因进行定量,结果表明,VvOMT2/3 的GUS 基因相对表达量呈先升高后降低趋势,分别在处理3 h和6 h时达到最高,是对照的30.77倍和36.40倍(图4-B)。GUS酶活活性测定结果表明,转化VvOMT2 和VvOMT3 启动子的烟草叶片中GUS酶活有相同趋势,均在3 h和12 h出现"双峰",且VvOMT3 和VvOMT2 叶片中GUS酶活活性均在3 h达到最高,分别是对照的15.13倍和18.64倍(图4-C)。因此,在烟草瞬时转化体系中VvOMT2 和VvOMT3 均会受到甘露醇的诱导表达,且VvOMT3 响应略高于VvOMT2。
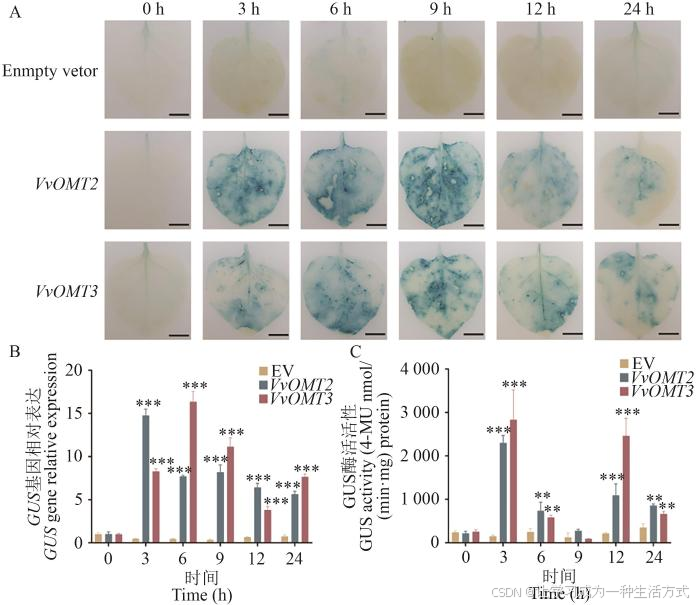
图4 '马瑟兰'葡萄VvOMTs基因启动子对甘露醇的响应
A:空载体、VvOMT2/3 基因启动子在甘露醇处理后烟草叶片的GUS染色,bar=1 cm;B:GUS基因相对表达水平;C:GUS蛋白酶活活性
2.5 葡萄VvOMTs基因启动子对MeJA的响应
茉莉酸甲酯(MeJA)作为与损伤相关的植物激素和信号分子,广泛地存在于植物体中,外源应用能够激发防御植物基因的表达,诱导植物的化学防御。烟草叶片GUS染色结果表明,喷施MeJA 0 h后,转化VvOMT2 和VvOMT3 的烟草叶片叶柄和主叶脉处出现蓝色,3‒24 h均对MeJA有不同程度的响应,3‒12 h蓝色范围和强度较高,24 h蓝色强度明显下降,空载体(阴性对照)未出现蓝色(图5-A)。通过对MeJA处理下转化空载体和VvOMT2/3 启动子的烟草叶片中GUS 基因进行定量,结果表明,VvOMT2/3 的GUS 基因表达量呈先升高后降低趋势,分别在处理3 h和6 h GUS 基因表达水平达到最高,是对照的14.09倍和34.15倍(图5-B)。GUS酶活活性测定结果表明,转化VvOMT2 启动子的烟草叶片中GUS酶活呈先升高后降低,在3 h和9 h出现"双峰",3 h达到最高,是对照的4.50倍(图5-C);转化VvOMT2 启动子的烟草叶片中GUS酶活呈先升高后平稳趋势,在6 h达到最高,是对照的3.00倍(图5-C)。因此,在烟草瞬时转化体系中VvOMT2 /3 均会受到MeJA的诱导表达,且VvOMT2响应更快。
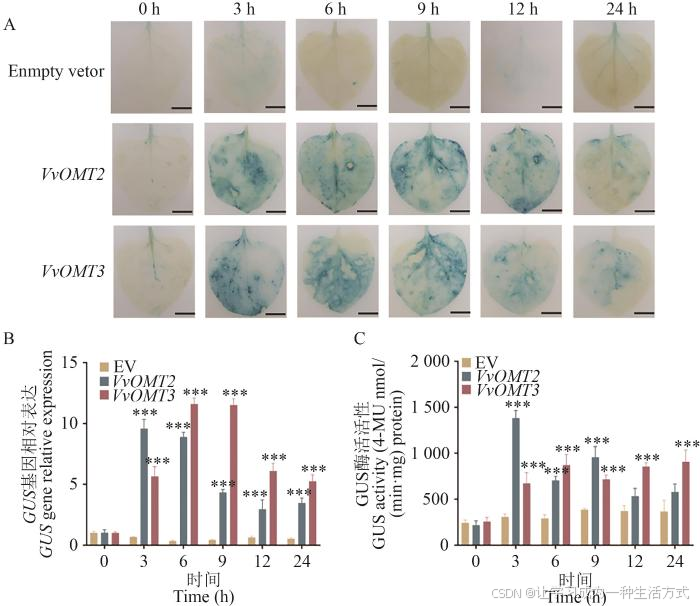
图5 '马瑟兰'葡萄VvOMTs基因启动子对MeJA的响应
A:空载体、VvOMT2/3 基因启动子在MeJA处理后烟草叶片的GUS染色,bar=1 cm;B:GUS基因相对表达水平;C:GUS蛋白酶活活性
3 讨论
O -甲氧基转移酶(OMT)根据氨基酸序列、大小和底物偏好可分为两大类:I类CCoAOMTs和Ⅱ类OMTs[7]。研究表明,多数OMTs 基因主要参与甲基化木质素[18]、花色苷[19]及多氧基黄酮[10]等次生代谢物质的合成,而葡萄中MPs仅存在于IBMP和SBMP的物质含量变化研究,并未对VvOMTs 家族基因功能和启动子活性进行深入研究。先前研究表明,柑橘CreOMT3/4/5 对多甲氧基黄酮PMFs的合成至关重要[10];辣椒COMT36 主要参与辣椒素和其前体阿魏酸之间的生物合成[20];陆地棉GhOMT1 在花青素甲基化和总花青素积累中起关键作用[21],但葡萄中调控此类物质合成的VvOMTs 家族仅存在基因定量数据的表面研究,并未报道出发挥功能的关键基因,未来可重点关注葡萄VvOMTs基因家族在调控花色苷等类黄酮物质中发挥的重要功能。
上游启动子序列顺式作用元件分析可以为植物生长发育、逆境胁迫和信号传导途径提供新线索[22]。前人研究发现,水分胁迫可显著增加ABA和MeJA含量[23],抑制酿酒葡萄中MPs积累[14],本研究结果表明,VvOMTs 家族基因的启动子区域中含有大量激素响应元件,VvOMT2 和VvOMT3 的启动子活性受MeJA、ABA和干旱胁迫的响应。此外,研究表明,西瓜CICOMT1 参与褪黑素的生物合成提高西瓜对低温、干旱和高盐胁迫的耐性[12]。水稻OsMPK6-OsWRKY67-OsNOMT 模块调控樱花素的生物合成并增强稻曲病的抗性[24]。因此,探讨ABA、MeJA和干旱对VvOMT2 和VvOMT3 的启动子响应对揭示MPs的积累规律和提高葡萄抗旱性至关重要。同时,VvOMT2 和VvOMT3 的启动子序列中存在大量光响应元件和转录因子结合元件,后期研究可聚焦光照处理和转录因子对VvOMT2 和VvOMT3启动子的响应,进而揭示MPs生物合成的上游调控因子。
研究表明,小麦WRAB18 基因启动子作用元件存在并受ABA(ABRE)、低温(LTRE)和赤霉素(GARE)信号分子的诱导调控[25],与本研究中VvOMT2 和VvOMT3 启动子响应ABA和MeJA的结果一致。此外,定点突变试验发现拟南芥中UGT79B2 启动子上响应干旱胁迫的关键元件为DREB元件[26],而本研究发现VvOMT2 和VvOMT3 启动子响应干旱胁迫主要是ABRE/ABF元件发挥功能,这主要因为干旱胁迫诱导型基因主要通过依赖ABA途径(ABRE/ABF)和不依赖ABA途径(DREB)参与应答。本课题组前期研究表明,VvOMT2 和VvOMT3 是调控SBMP和IPMP的关键基因,VvOMTs蛋白均含有1个甲氧基转移酶功能的保守结构域,说明家族成员间差异较小,预示该家族基因在葡萄MPs合成中发挥相似的调控功能,但VvOMT1 和VvOMT4 的具体的调控机制有待进一步深入研究。在后期研究中,可转化葡萄果实和愈伤组织对VvOMT1 和VvOMT4 进行基因功能验证,同时利用分子生物学方法,以VvOMT2 和VvOMT3的基因启动子区为靶点,筛选调控其启动子活性的上游转录因子,进而明确MPs生物合成的分子调控机制。
4 结论
从葡萄基因组中共鉴定出4个调控甲氧基吡嗪合成的甲氧基转移酶基因(VvOMT1 -4 ),定位细胞质膜并均匀分布在第3和12号染色体上。VvOMT2 /3基因启动子参与干旱、ABA和MeJA响应,并受其调控。