作者,Evil Genius
今天我们分享顶刊,肿瘤微生物方向。
知识积累
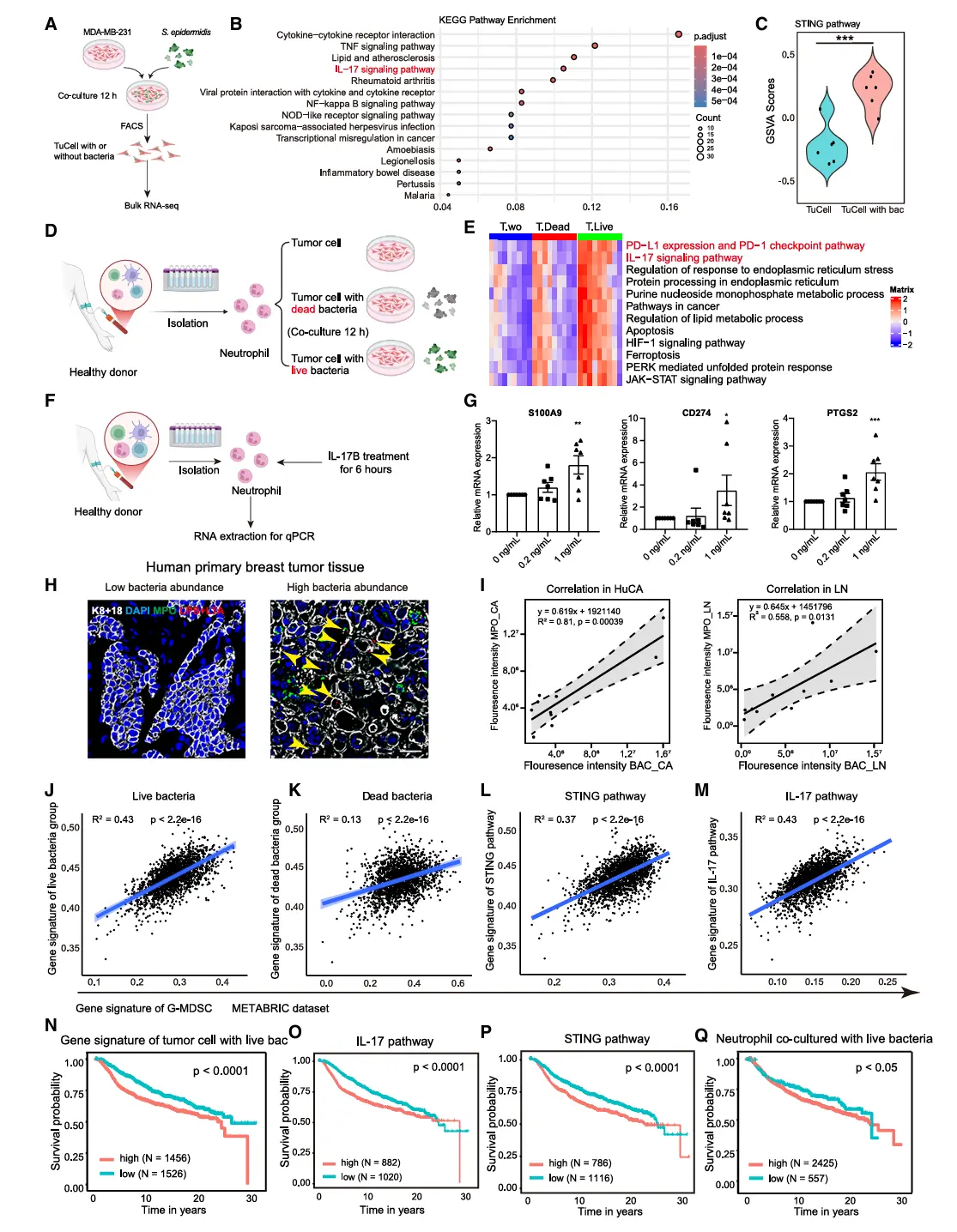
肿瘤内细菌是癌症生态系统中一个研究尚浅但颇具影响力的组成部分,对癌症进展具有关键影响。 在PyMT乳腺肿瘤中,发现当细菌定位于癌细胞胞质内时,会通过触发胞质内双链DNA积累而促进转移;这种积累进而激活肿瘤固有的cGAS-STING-白细胞介素-17B通路,并促使中性粒细胞向抑制细胞毒性T细胞的促肿瘤表型转化。相比之下,同一菌株当其存在于细胞外时,则在不激活STING通路的情况下诱导抗肿瘤的中性粒细胞活性。
生理层面, 在临床前模型中,清除细胞内细菌,或治疗层面, 引入细胞外细菌组分,均可消除免疫抑制并防止术后转移复发。临床层面, 我们开发的细菌侵袭特征与乳腺癌患者的不良预后相关。
总而言之, 转移灶中细菌与宿主细胞之间的空间相互作用可塑造截然不同的肿瘤免疫反应,这凸显了细菌-宿主接触是癌症免疫调节的关键决定因素和潜在治疗靶点。
肿瘤内微生物群(包括细菌、真菌及其他微生物)已成为影响多种癌症发生、进展及治疗反应的关键因素。尤其对于占癌症相关死亡率90%的癌症转移,越来越多的证据表明肿瘤内细菌可通过增强致癌通路、提升对流体剪切力的抵抗、促进细胞粘附等方式,从本质上增强癌细胞能力,从而助推转移过程。
当转移性肿瘤细胞抵达远处器官时,面临规避组织驻留性和系统性免疫攻击的巨大挑战。癌细胞采用多种策略建立宏观转移灶,例如通过远程传递外泌体以预备转移前微环境,以及劫持中性粒细胞、巨噬细胞和血小板以营造有利的免疫环境。此前已发现循环肿瘤细胞在转移过程中可携带肿瘤内细菌,且被细菌侵入的肿瘤细胞会上调多种可能影响免疫环境的免疫相关信号。近期通过对原发性患者肿瘤的空间测序及转移性癌症的队列研究显示,不同的肿瘤内细菌可能与不同的免疫特征和活性相关。
细胞内细菌通过激活癌细胞中的环鸟苷酸-腺苷酸合成酶-干扰素基因刺激因子-白细胞介素17B轴,主导形成以中性粒细胞为主的免疫抑制环境,从而促进转移灶生长;相比之下,细胞外细菌则增强抗肿瘤免疫反应。这种功能差异决定了二者对原发肿瘤切除后转移复发的相反影响。研究证实,细菌-宿主相互作用的模式(细胞内 vs. 细胞外)是决定转移进展的关键因素,并凸显其作为预防转移复发的潜在治疗靶点。
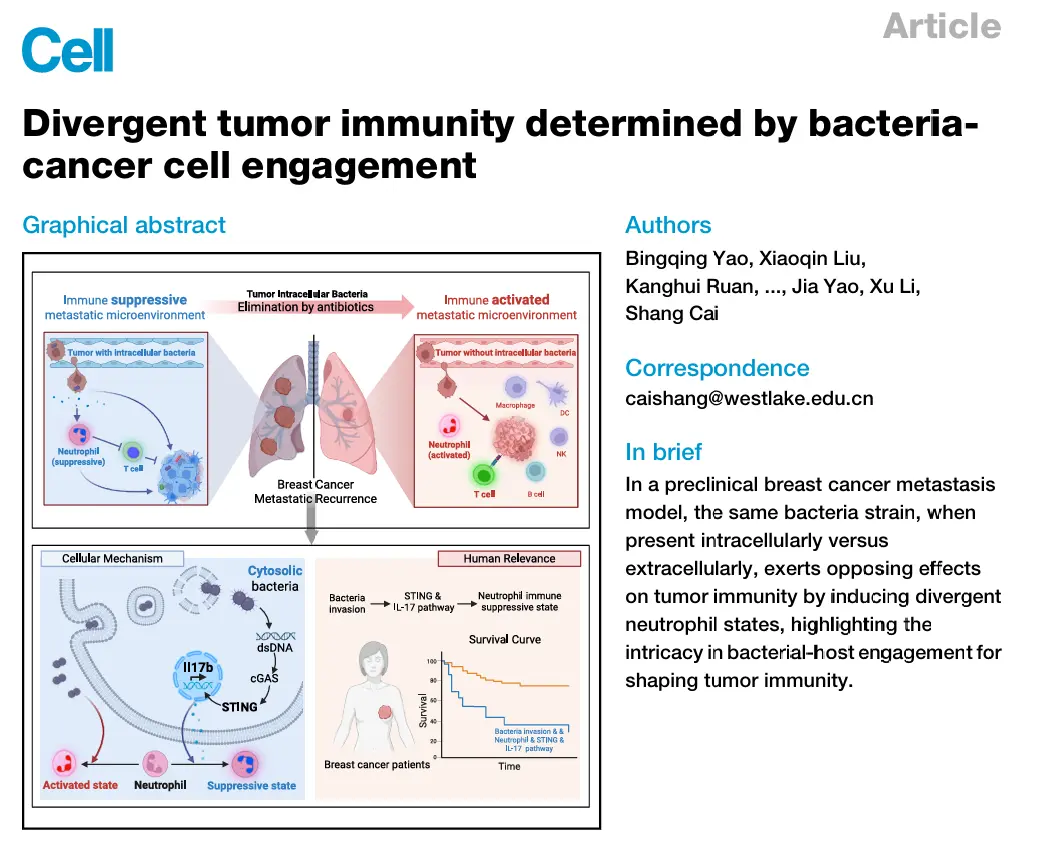
结果1、肿瘤内细菌促进肺转移复发
肿瘤内栖息的细胞内细菌可增强肿瘤细胞对流体剪切力的抵抗能力,提高转移过程中的存活率。然而,肿瘤内细菌的促转移作用不仅限于其对机械应力的调控,因为在具有机械应力抵抗能力的 p190/Arhgap35(p190过表达)肿瘤细胞系中,细菌侵入仍能为宿主细胞提供生存优势,且细菌对癌细胞的影响被发现具有免疫依赖性。
肿瘤内细菌促进乳腺肿瘤肺转移的作用是免疫依赖性的。
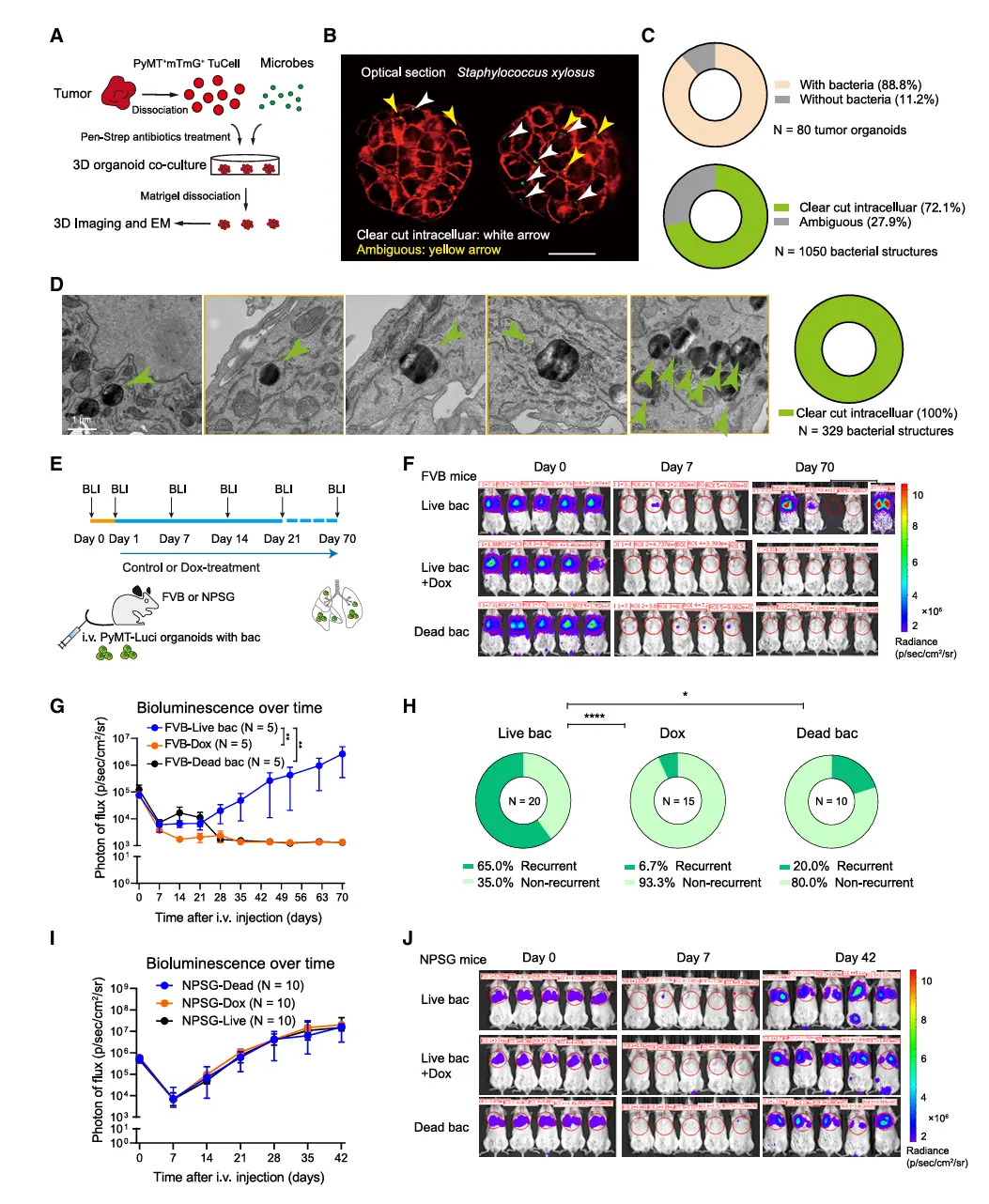
结果2、肿瘤内细菌在转移定植时招募中性粒细胞
在生理条件下,转移性肺脏中的中性粒细胞招募部分依赖于肿瘤内细菌的存在。
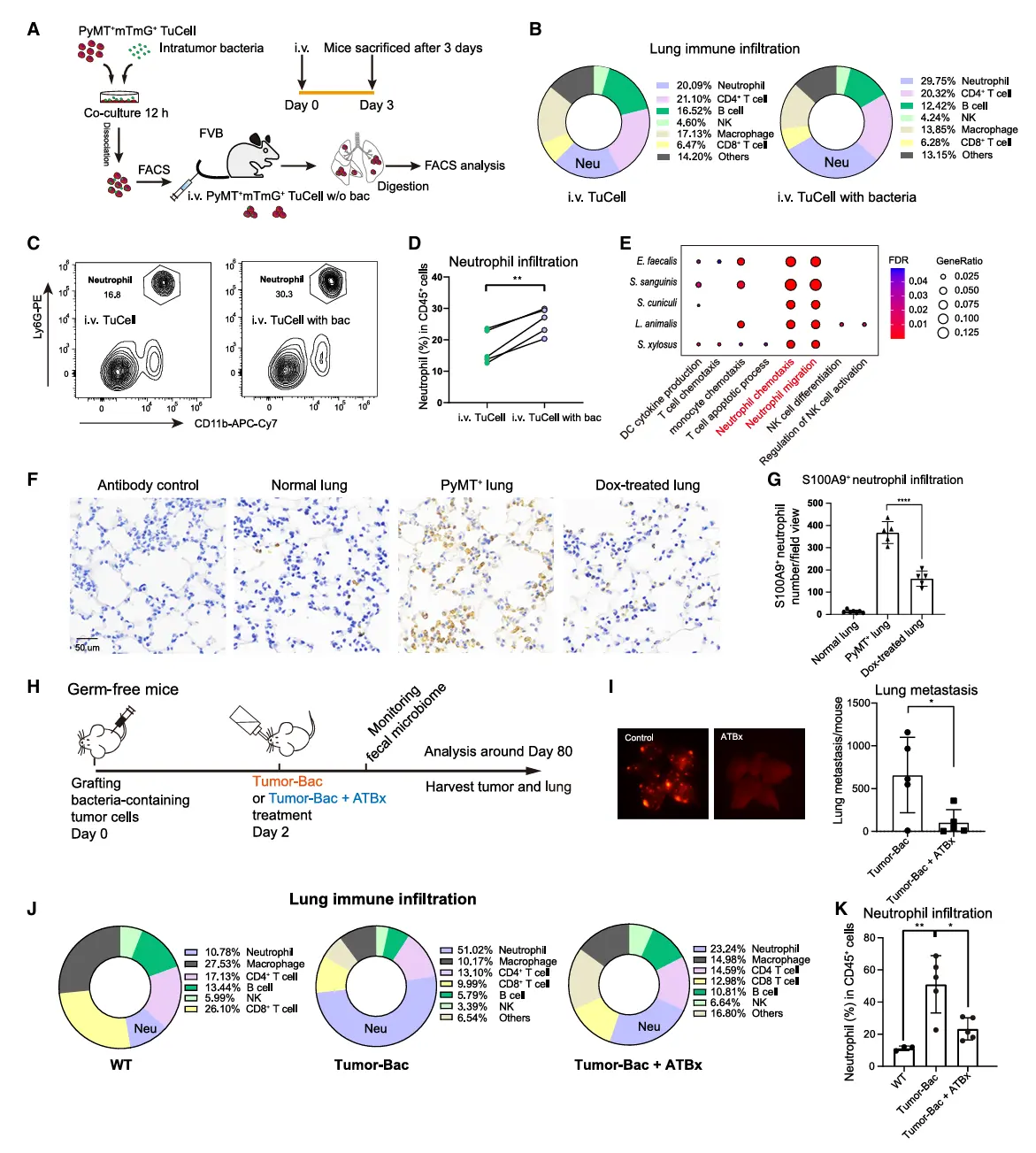
结果3、胞内/胞外细菌诱导不同的中性粒细胞状态
单细胞测序结果证实,抗生素介导的肿瘤微生物群清除显著减少了含细菌肿瘤诱导的中性粒细胞招募。
肿瘤内细菌有助于建立免疫抑制微环境,而抗生素处理可逆转此过程。
从单细胞测序数据中提取中性粒细胞进行相关性分析时发现,与野生型小鼠相比,含细菌肿瘤细胞诱导了不同的中性粒细胞状态,该状态可被抗生素处理逆转。
肿瘤内细菌在驱动中性粒细胞向免疫抑制状态转化中的作用,从而促进肿瘤进展。
细菌在肿瘤微环境中的定位可能深刻影响中性粒细胞的发育轨迹:胞外细菌选择性促进抗原呈递型中性粒细胞扩增,而胞内细菌则使中性粒细胞向更具免疫抑制性的表型偏移。
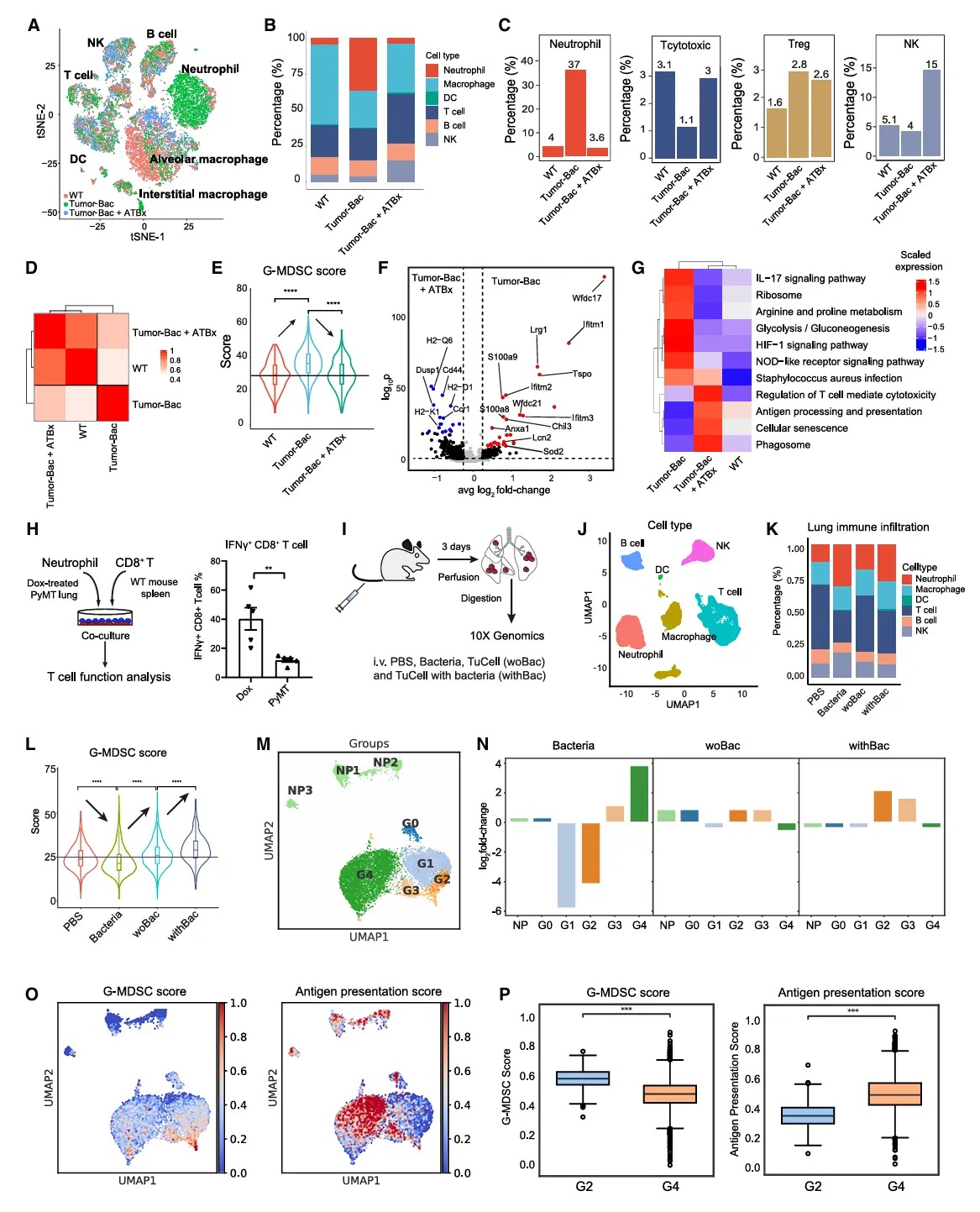
结果4、胞内细菌通过IL-17B诱导中性粒细胞促肿瘤命运转化
胞内细菌通过诱导肿瘤细胞表达IL-17B,驱动中性粒细胞向促肿瘤表型转化,从而建立免疫抑制性微环境、促进转移复发;该机制具有菌株普适性,且依赖中性粒细胞介导的免疫抑制通路。
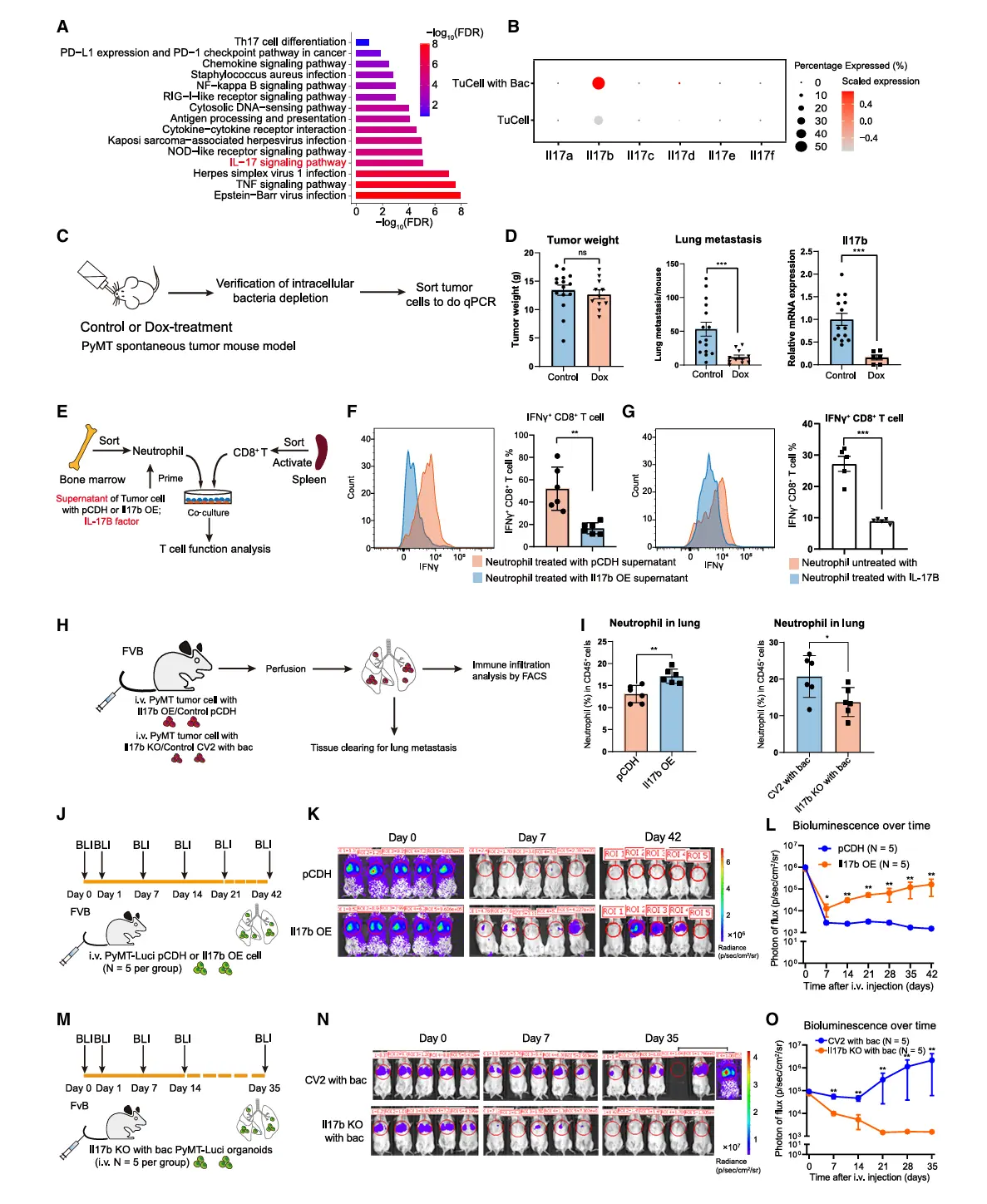
结果5、细菌侵入通过cGAS-STING通路诱导IL-17B表达
细菌对中性粒细胞的调控作用取决于其在宿主细胞内的定位,仅活细菌侵入肿瘤细胞才能触发促肿瘤中性粒细胞转化及转移进展。
单细胞及RNA测序分析显示,活细菌侵入显著激活病毒相关通路(包括STING及DNA感知通路),而死细菌无此作用。进一步实验证实:
STING通路激活足以诱导Il17b上调:使用细菌或哺乳动物来源的环二核苷酸通过脂质体递送至细胞内,均能激活STING通路并升高Il17b表达;
Il17b上调依赖完整cGAS-STING通路:STING或cGAS基因敲除完全阻断细菌侵入诱导的Il17b表达;
机制层面:细菌侵入导致肿瘤细胞胞质内非线粒体DNA积累,通过cGAS-STING-RELA/STAT3信号轴驱动Il17b转录。
相比之下,胞外细菌成分(如LPS/PGN)通过TLR激活NF-κB通路,但未能诱导Ifnb1或Il17b表达。同一小鼠体内分离的木糖葡萄球菌菌株中,仅高侵入能力菌株可有效激活IFN-β通路并上调IL-17B蛋白,表明细菌与宿主细胞的相互作用模式决定了下游免疫调控效应的差异。
综上,细菌侵入性内化通过触发胞质dsDNA-cGAS-STING信号轴特异性诱导IL-17B表达,进而驱动免疫抑制性微环境形成,而胞外细菌成分无法启动该通路。
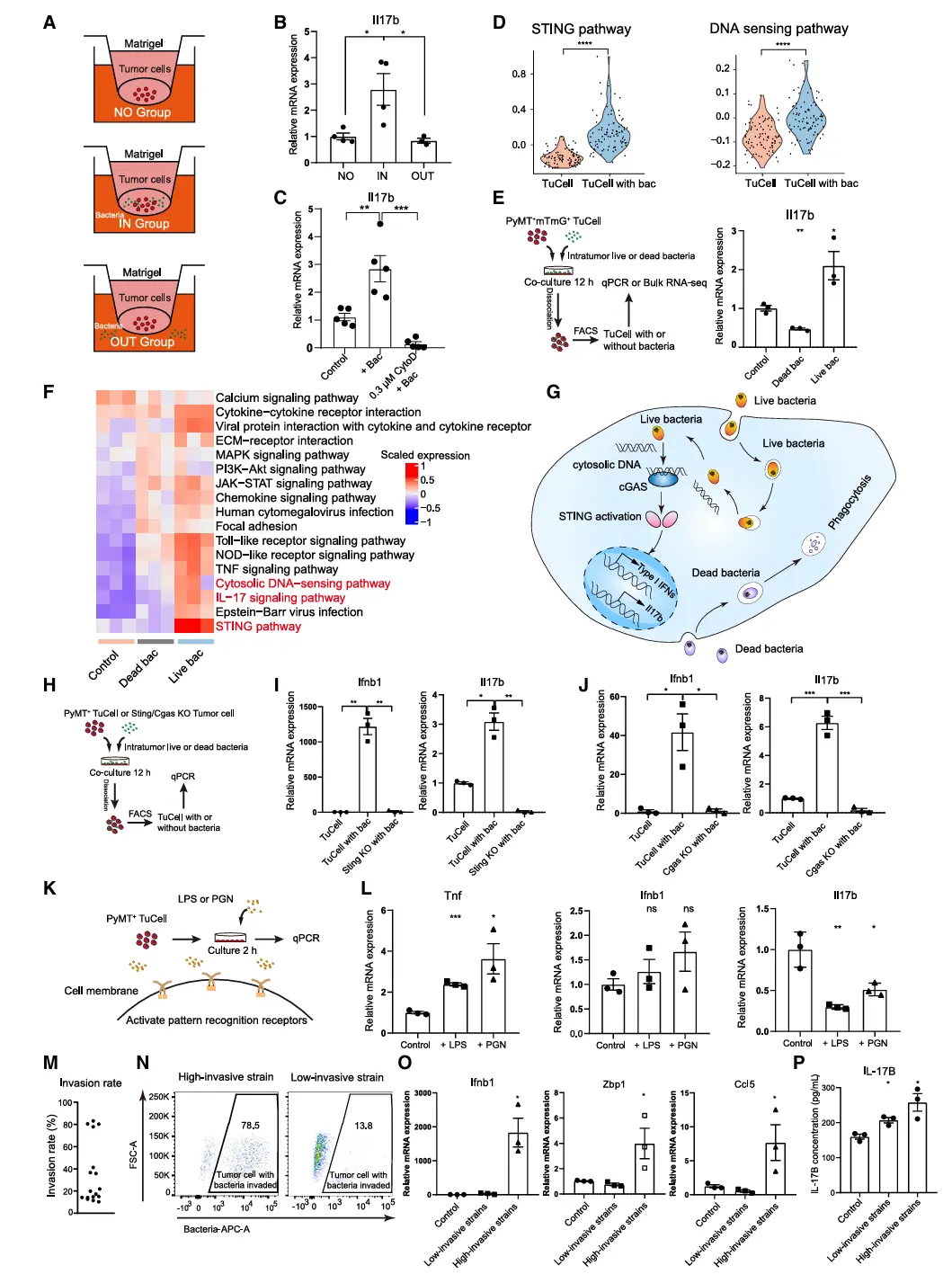
结果6、清除肿瘤内细菌可抑制术后转移复发
通过构建模拟临床术后复发的PyMT⁺ mTmG⁺小鼠模型发现:
肿瘤内细菌是术后复发的关键驱动因素
在自发肿瘤移植模型中,87%的小鼠术后出现肺转移复发。使用多西环素清除肿瘤内细菌后,肺转移复发率从80%显著降至20%,且肺中性粒细胞浸润减少。
复发机制依赖中性粒细胞功能
术后使用抗Ly6G抗体清除中性粒细胞可完全阻断复发,证实肿瘤内细菌通过调控中性粒细胞功能促进转移复发。
胞外细菌成分具有抑制复发的作用
术后鼻内给予细菌细胞壁成分LPS/PGN(模拟胞外细菌)可显著减少肺转移灶,并延长小鼠生存期,同时降低中性粒细胞浸润,其作用与胞内细菌相反。
综上,肿瘤内细菌通过中性粒细胞依赖性机制驱动术后转移复发,而胞外细菌成分则具有抑制复发的保护性作用,提示针对细菌定位的干预策略可能具有临床转化潜力。
结果7、人类乳腺癌中保守的细菌-宿主细胞-中性粒细胞互作机制
通过对人类乳腺肿瘤内细菌的分离鉴定,发现表皮葡萄球菌(占分离葡萄球菌菌株的81.82%)是主要菌种。实验发现:
细菌侵入触发保守信号通路
表皮葡萄球菌侵入人乳腺癌细胞MDA-MB-231后,IL-17信号通路和STING通路显著激活,与小鼠肿瘤模型反应一致。
细菌重塑人中性粒细胞状态
细菌侵入的肿瘤细胞条件培养基能将人外周血中性粒细胞重编程为MDSC样抑制状态,上调S100A8/9、CD274(PD-L1)、CXCL2等免疫抑制相关基因,并富集PD-1/PD-L1与IL-17通路。而单纯癌细胞或死菌处理无此效应。
IL-17B具有保守调控功能
人重组IL-17B蛋白处理可诱导中性粒细胞表达CD274、PTGS2、S100A9等MDSC特征基因,证实IL-17B在人类系统中同样驱动中性粒细胞向抑制表型转化。
临床样本验证细菌与中性粒细胞关联
在原发灶和淋巴结转移的乳腺癌样本中,细菌信号强度与MPO⁺中性粒细胞浸润呈显著正相关(原发灶R²=0.81,转移灶R²=0.558)。
细菌侵入特征与患者预后不良相关
基于METABRIC数据库分析显示:
活细菌侵入特征与粒细胞样MDSC特征正相关(R²=0.43),死菌处理特征相关性较弱(R²=0.13);
STING通路与IL-17通路均与G-MDSC评分正相关;
细菌侵入特征、中性粒细胞应答特征、STING及IL-17通路激活均与乳腺癌患者不良预后显著相关,且在各乳腺癌亚型中具有普适预后价值。
人类乳腺癌中存在保守的细菌-肿瘤细胞-中性粒细胞互作轴,其中细菌侵入通过激活cGAS-STING-IL-17B通路驱动中性粒细胞向免疫抑制表型转化,进而促进肿瘤进展,这为靶向肿瘤内细菌的干预策略提供了临床依据。