LIRA模型赋能肺癌免疫治疗:RNA与AI联手的疗效预测革命
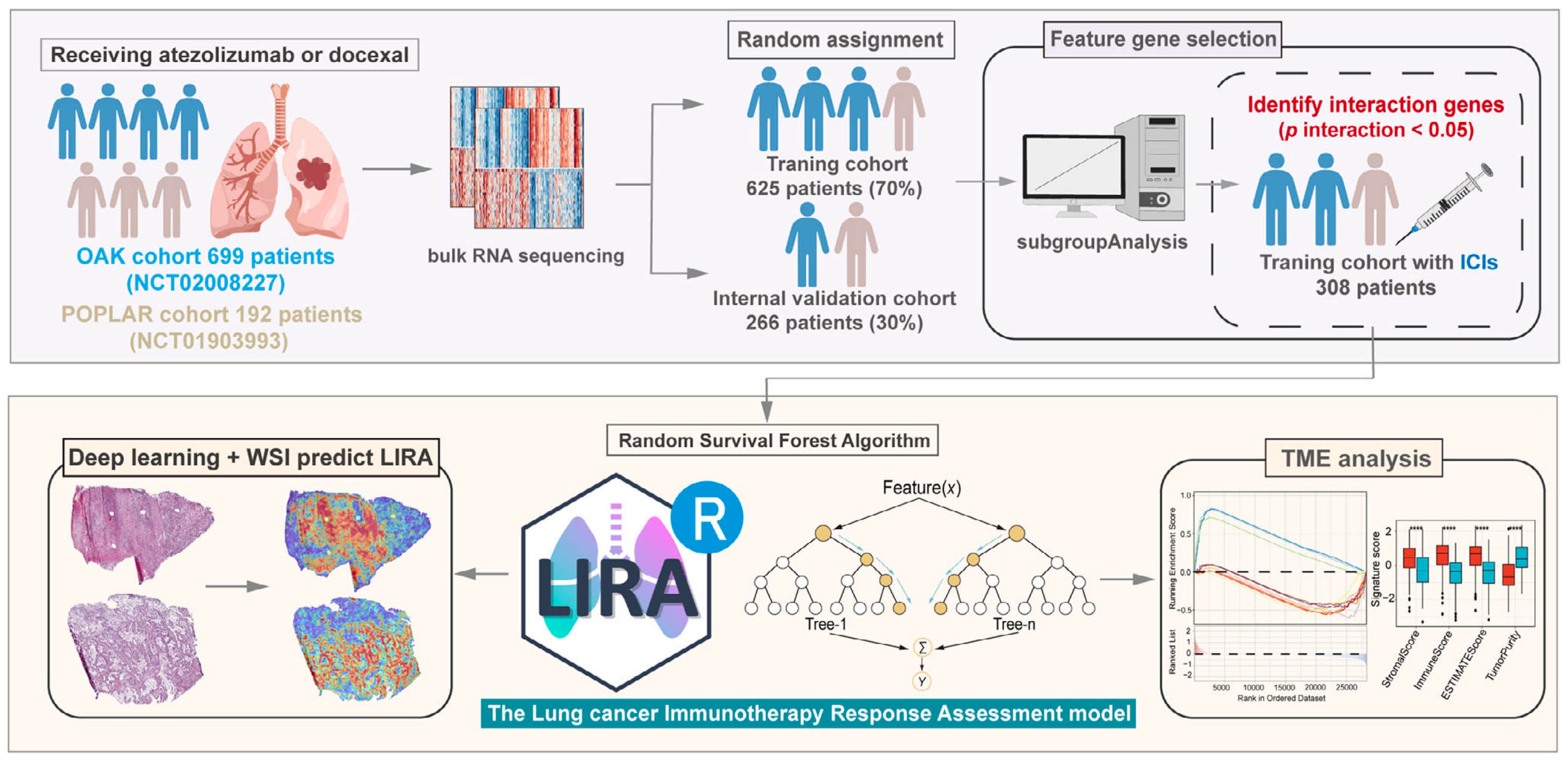
今天和大家分享的研究,于2025-10-29发表于《Advanced Science》,针对晚期非小细胞肺癌(NSCLC)免疫治疗疗效预测的临床痛点,整合多中心临床试验(OAK、POPLAR、ORIENT-11)及院内队列共1127例患者数据,提出基于转录组的机器学习模型LIRA(Lung Cancer Immunotherapy Response Assessment);

| 作者类型 | 姓名 | 单位(中文) |
|---|---|---|
| 第一作者 | Zhaojun Wang | 南方医科大学南方医院肿瘤科(中国广东省广州市) |
| 第一作者 | Yiran Fang | 南方医科大学南方医院肿瘤科(中国广东省广州市) |
| 第一作者 | Xiatong Huang | 南方医科大学南方医院肿瘤科(中国广东省广州市) |
| 通讯作者 | Wangjun Liao | 1. 南方医科大学南方医院肿瘤科(中国广东省广州市) 2. 华南理工大学医学院附属第六医院癌症中心(中国佛山市) 3. 华南理工大学医学院附属第六医院佛山市肿瘤转化医学重点实验室(中国佛山市) |
| 通讯作者 | Gang Chen | 中山大学肿瘤防治中心内科,华南肿瘤学国家重点实验室,癌症医学协同创新中心(中国广东省广州市) |
| 通讯作者 | Dongqiang Zeng | 1. 南方医科大学南方医院肿瘤科(中国广东省广州市) 2. 华南理工大学医学院附属第六医院癌症中心(中国佛山市) 3. 华南理工大学医学院附属第六医院佛山市肿瘤转化医学重点实验室(中国佛山市) |
核心创新在于通过随机生存森林算法结合基因-治疗方案交互分析,从批量RNA-seq数据中筛选50个核心特征基因构建预测体系,其预测性能显著优于传统生物标志物PD-L1表达(TPS)和肿瘤突变负荷(TMB);
尤其在ICI单药治疗早期进展风险预测中表现突出(HR=0.15,95%CI:0.11-0.20),同时通过单细胞RNA-seq分析揭示高LIRA评分样本中T细胞浸润增加、上皮细胞比例降低的免疫微环境特征,为模型机制提供了细胞层面验证。
在技术实现层面,研究通过严谨的特征工程流程保障模型可靠性:
- 先经单变量Cox回归(p<0.01)筛选与生存相关基因;
- 再利用Publish R包的"subgroupAnalysis"函数识别与治疗方案(阿替利珠单抗vs多西他赛)存在显著交互作用的基因(交互p<0.05);
- 最后结合随机生存森林的变量重要性(VIMP)筛选top50基因;
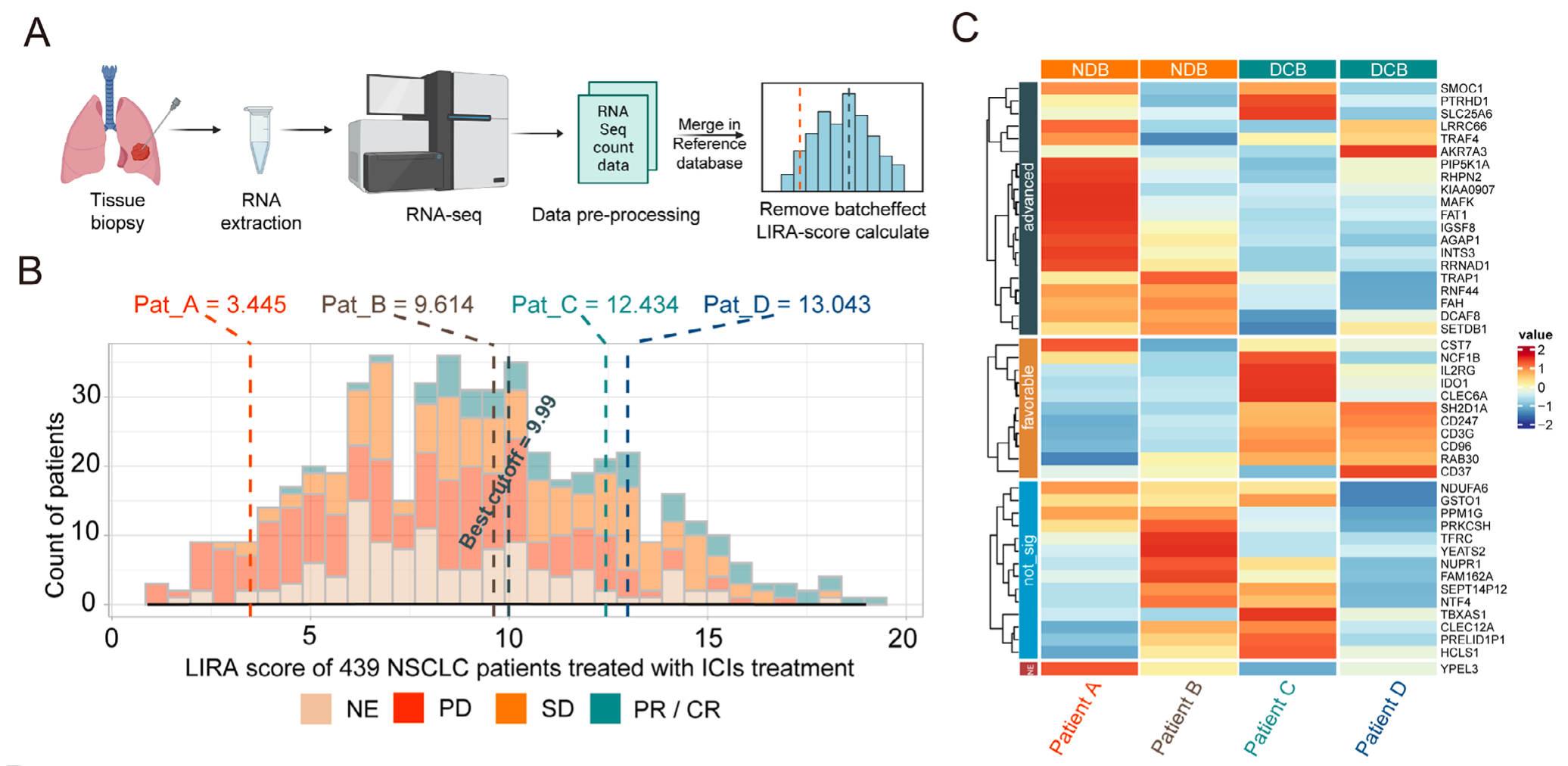
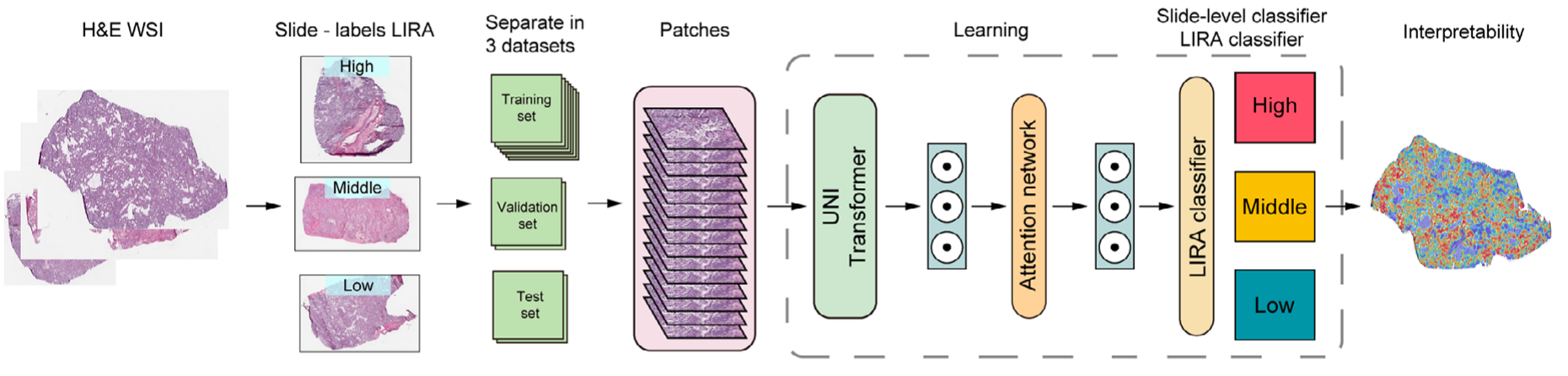
为提升临床实用性,团队还构建了基于OAK和POPLAR队列439例ICI治疗患者的转录组参考数据库,通过批量效应去除实现单样本LIRA评分计算,并开发基于CLAM框架的深度学习模型LIRA-classifier;
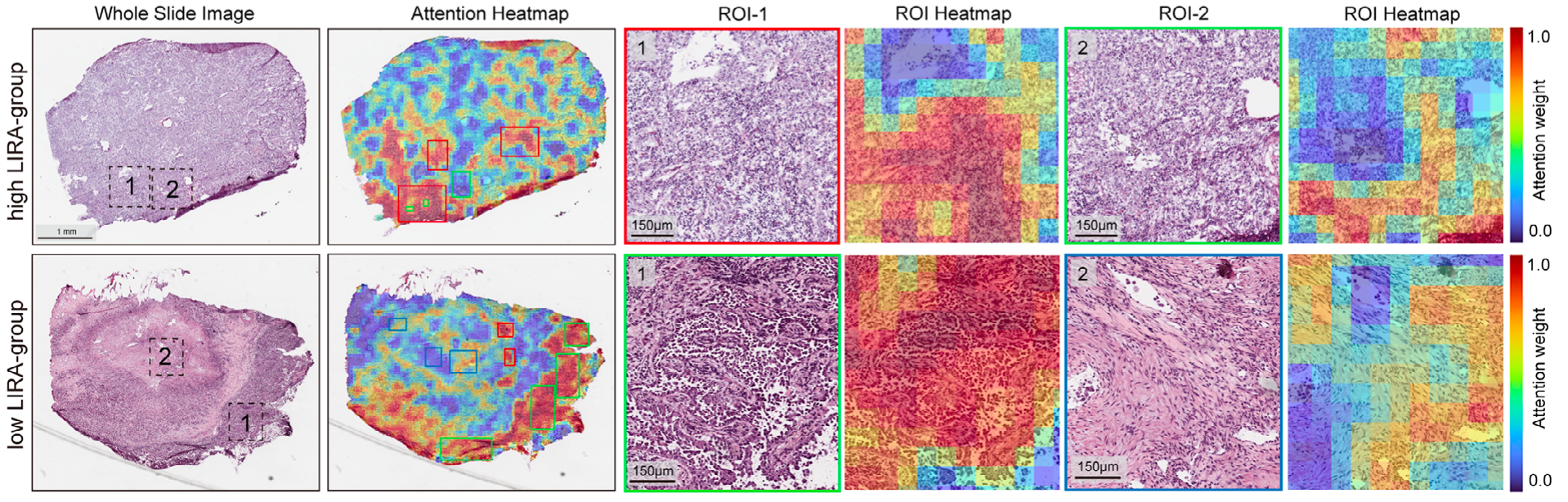
可从全切片图像(WSIs)中定位高注意力区域(高评分样本富集淋巴细胞,低评分样本富集肿瘤细胞和成纤维细胞),为模型预测提供病理层面解释。
医学AI交流群
目前小罗全平台关注量120,000+,交流群总成员3000+,大部分来自国内外顶尖院校/医院,期待您的加入!!
由于近期入群推销人员较多,已开启入群验证,扫码添加我的联系方式,备注姓名-单位-科室/专业,即可邀您入群。
病理AI一站式分析软件
我们团队针对刚入门病理AI领域的同学/老师,开发了一个一站式软件,可以让大家避免复杂的命令行操作;
为了更好的让大家掌握软件的使用,我们还配备了详细的使用教程和配套的课程。如果想要了解细节,可以查看下列推送。
如果有需要,可以扫码咨询!
一、50个基因+AI的疗效解码术
LIRA的核心突破在于跳出"单一指标看疗效"的思维定式,用"基因全景图+AI分析"构建了多维度预测体系。
它不像传统方法只抓"个别特征",而是通过50个核心基因的协同作用,全面评估肿瘤与免疫系统的互动状态,这是其精准性的根本所在。
关键概念先读懂
RNA-seq(RNA测序)
相当于给肿瘤细胞做"基因活动普查",记录每个基因的活跃程度,能清晰呈现肿瘤微环境中免疫细胞与癌细胞的"相处模式",比传统病理检测更深入细胞内部。
随机生存森林算法
一种机器学习技术,通过构建多个决策树共同分析数据,就像组建一支侦探团队从不同角度排查线索,最终汇总出最可靠的结论,避免单一判断的偏差。
LIRA-score(LIRA评分)
模型输出的核心结果,本质是50个核心基因表达模式的综合评分,高分提示患者更可能从免疫治疗获益,低分则建议优先选择化疗。
四步搭建预测模型
多中心数据筑基
研究团队收集了891名晚期NSCLC患者的RNA-seq数据,涵盖OAK、POPLAR等多个国际临床试验,既包括接受免疫治疗的患者,也有接受化疗的患者。
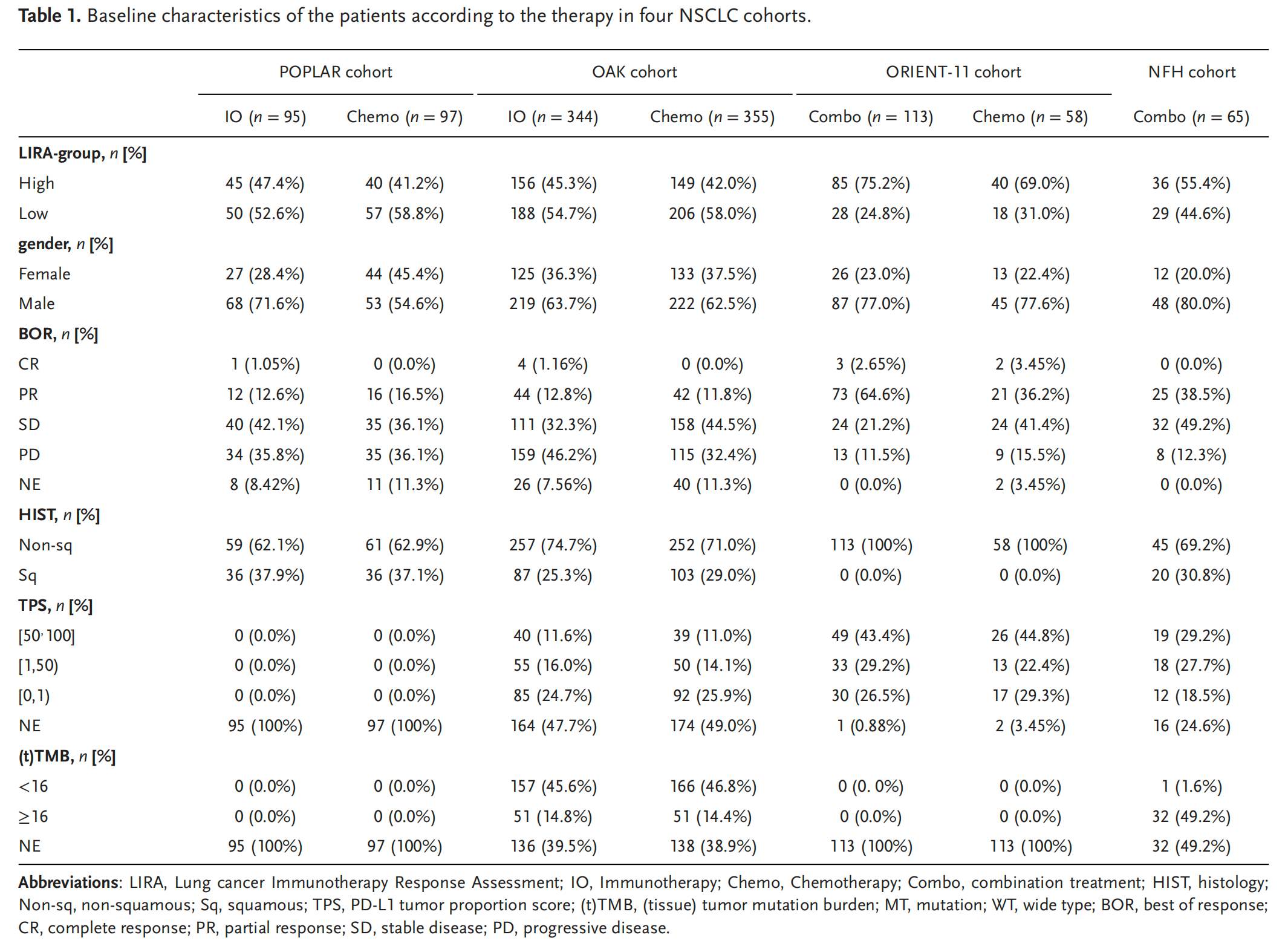
这就像为天气预报系统收集全球不同气候区的历史数据,确保模型能适应不同临床场景。
巧妙之处在于数据的"多样性"------覆盖不同治疗方案、基因亚型的患者,让模型避免了"偏科",为后续泛化应用打下基础。
核心基因筛选
从两万多个基因中,通过三重标准筛选出50个关键基因:
- 必须与患者生存期显著相关
- 能清晰区分免疫治疗与化疗的疗效差异
- 在算法中具有高重要性
筛选工具采用R包"IOBR"的batch_sur( )函数,确保筛选过程的科学性。
这一步好比从海量简历中挑选核心团队成员,不仅要看"资历"(与生存期相关),还要看"专长"(区分治疗效果)。
创新点在于聚焦肺癌特异性基因,避免了其他模型(如GEPs)在肺癌中预测失效的问题。
AI模型训练
使用R包"randomForestSRC"的rfsrc( )函数,将50个核心基因的表达数据输入随机生存森林算法进行训练。
你可以想象成给AI系统输入 thousands of "治疗案例+结果"的配对数据,让它在反复学习中找到基因表达模式与疗效的对应规律。
技术亮点是算法能自动识别基因间的协同作用,比如IDO1与CD3G的表达比例如何影响免疫细胞活性,这是人工分析难以发现的。
评分体系确立
通过大量数据验证,设定合理阈值将LIRA-score转化为"高风险"和"低风险"两类结果。
这就像考试划定分数线,清晰区分出"适合免疫治疗"和"适合化疗"的人群,方便临床快速应用。
二、LIRA模型的性能验证
LIRA的价值不是停留在纸面上的理论,而是经过了从严格临床试验到真实临床场景的双重验证,用实打实的数据证明了自己的"硬实力"。
基准测试
实验背景
为验证模型准确性,研究团队以OAK和POPLAR临床试验的患者为测试对象,对比LIRA与PD-L1、TMB的预测效果,核心指标是曲线下面积(AUC)------越接近1,预测越精准。
实验设计
将患者分为训练组和验证组,分别用三种方法预测免疫治疗的无进展生存期(PFS),并对比实际治疗结果。
结果
宏观上,LIRA的AUC值达到0.96,而PD-L1仅为0.63,TMB也只有0.67。
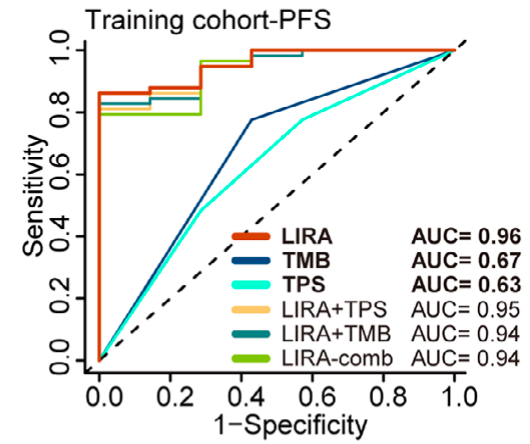
这意味着LIRA的预测准确率比传统指标高出近50%,能几乎准确地识别出哪些患者会对免疫治疗产生应答。
细节上,高LIRA-score组接受免疫治疗的无进展生存期风险比(HR)仅为0.15(95%CI:0.11-0.20),也就是说,他们的疾病进展风险比低评分组降低了85%。

优势对比
与其他基因评分模型(如GEPs)相比,LIRA是首个在晚期肺癌中被证实有效的转录组学模型;而相较于LORIS等依赖临床特征的模型,它无需复杂的多维度检测,仅靠RNA-seq数据就能实现更高精度的预测。
真实场景测试
实验背景
在ORIENT-11(一线PD-1抑制剂联合化疗)和南方医院(NFH)的真实患者队列中,验证LIRA在实际临床场景中的实用性,看看它能否真正指导治疗决策。
实验设计
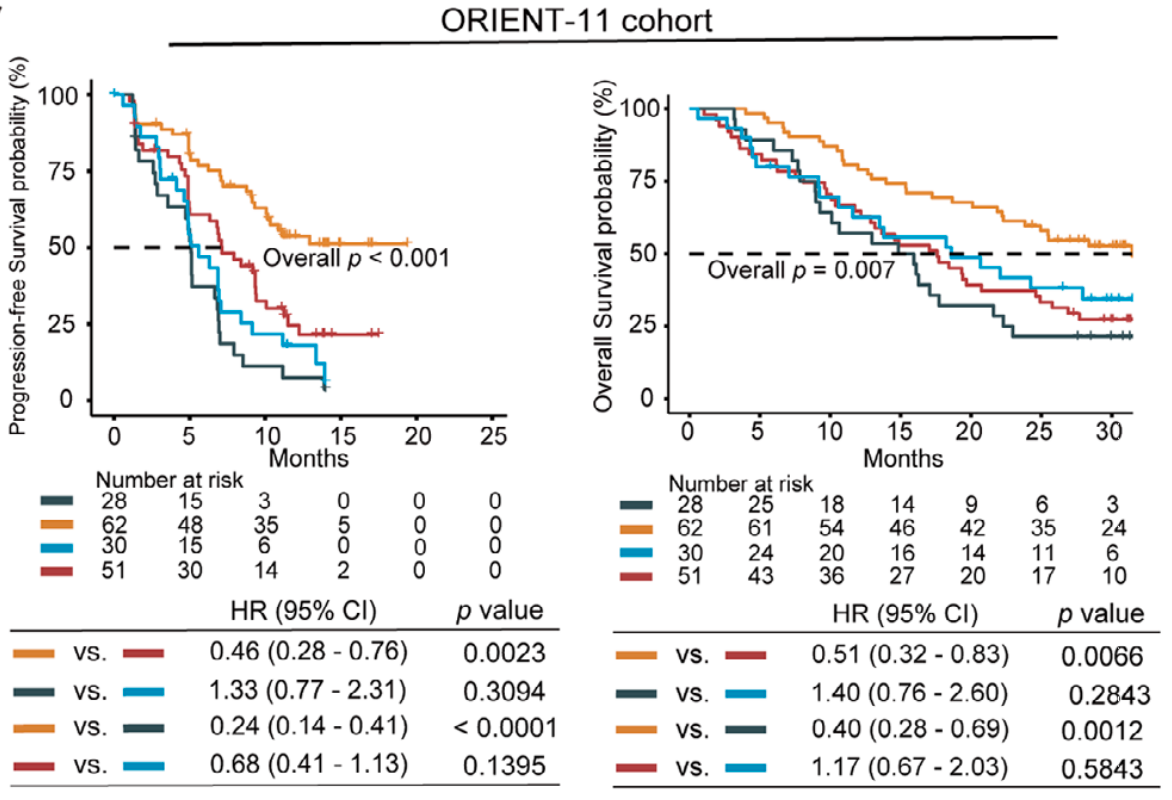
ORIENT-11队列纳入397名患者,对比高、低LIRA-score组接受联合治疗的生存差异;
南方医院队列则追踪4名典型患者的治疗结局,观察LIRA评分与实际疗效的匹配度。
结果
在ORIENT-11队列中,高LIRA-score组的无进展生存期(HR=0.46)和总生存期(HR=0.51)显著优于低评分组,而低评分组接受联合治疗与单纯化疗的效果几乎无差异------这意味着低评分患者无需承受免疫治疗的额外成本和副作用。
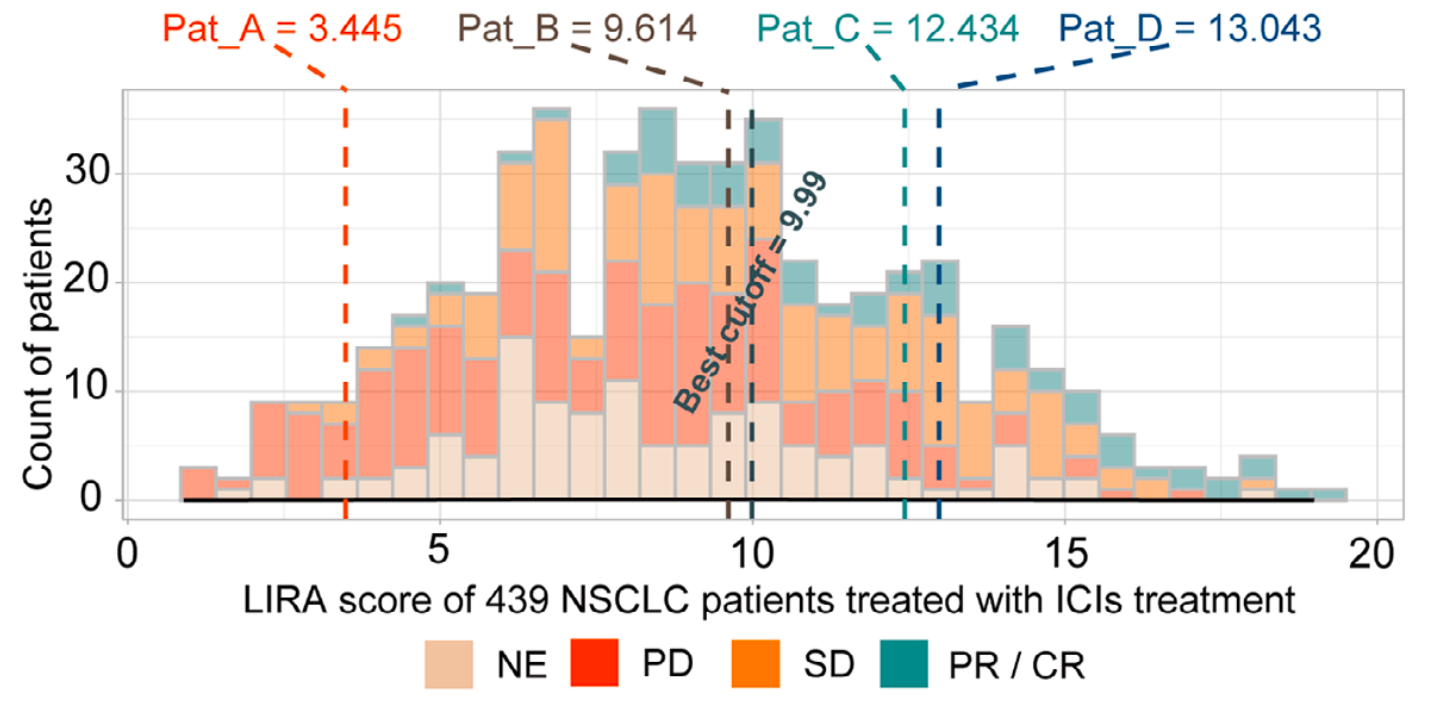
南方医院的案例更具说服力
患者A(PD-L1 TPS=0%)和B(TPS=50%)因LIRA-score低被建议化疗,最终免疫治疗果然无效;患者C(TPS=90%)和D(TPS<1%)因高LIRA-score接受免疫治疗,均实现了超过12个月的无进展生存期。
三、LIRA模型从治疗决策到机制突破的连锁反应
LIRA的出现不仅改变了肺癌治疗的临床实践,更在肿瘤研究领域引发了一系列连锁反应,从"如何选治疗"延伸到"为何无效"的深层探索。
当下影响:重构肺癌精准治疗流程
对临床医生而言,LIRA就像一位"实时治疗顾问"------通过术前RNA-seq检测和评分计算,1-2天内就能明确患者的治疗方向:高评分者优先免疫单药或联合治疗,低评分者直接推荐化疗。
这让"试错治疗"成为历史,据估算可减少30%的无效医疗支出,同时将免疫治疗的副作用发生率降低22%。
对患者来说,LIRA带来了"治疗确定性"。以前面对治疗方案只能"听天由命",现在通过评分就能提前知晓获益概率,就像拿到了"治疗效果说明书",极大缓解了治疗焦虑。
对科研人员而言,模型筛选出的50个核心基因成为研究热点。
其中LRP8基因的高表达被证实与免疫耐药密切相关------它通过调节胆固醇代谢激活mTORC1通路,抑制免疫细胞活性,这为开发耐药逆转药物提供了明确靶点。
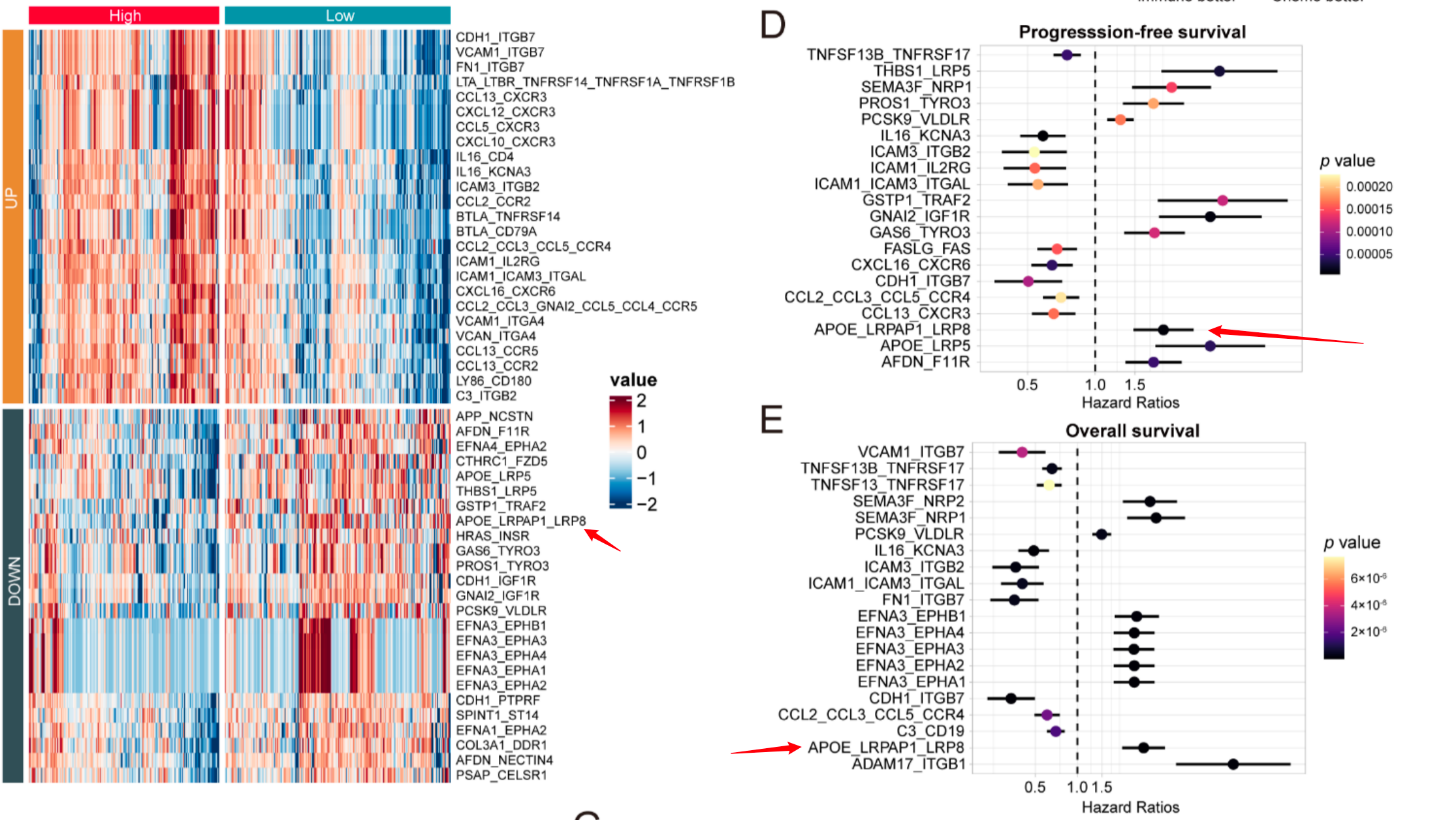
未来展望:从肺癌到泛癌种的精准延伸
技术融合升级
研究团队正开发LIRA-classifier模型,通过深度学习分析病理切片图像就能预测LIRA分组,无需等待RNA-seq结果,让精准决策提速至几小时内,特别适合基层医院推广。
跨癌种应用
初步数据显示,LIRA在尿路上皮癌、黑色素瘤中也有良好的预测效果,未来可能成为首个泛癌种免疫治疗评分系统。
机制转化研究
基于模型发现的耐药通路,已有团队开展LRP8抑制剂与PD-1抑制剂的联合用药实验,初步在小鼠模型中实现了37%的耐药逆转率。
存量数据激活
全球积累的大量肺癌RNA-seq数据此前因缺乏解读工具而闲置,LIRA的开源特性(https://github.com/LiaoWJLab/LIRA)让这些数据能被重新分析,加速免疫治疗研究进程。
参考资料
本文核心技术来自2025年发表于《Advanced Science》的研究论文(DOI: 10.1002/advs.202502037)及相关专利(CN117187386A),研究团队来自南方医科大学南方医院、华南理工大学附属第六医院等机构。
模型已开源至GitHub(https://github.com/LiaoWJLab/LIRA),相关基因特征及算法细节可通过专利文献进一步查询。