作者:电控工程手札
本博文内容著作权归作者所有,转载请务必保留本文链接
目录
- [1. 电池](#1. 电池)
- [2. "铜锌电池单元"示例](#2. “铜锌电池单元”示例)
-
- [2.1 构造](#2.1 构造)
- [2.2 发生的化学反应](#2.2 发生的化学反应)
- [2.3 电池原理](#2.3 电池原理)
- [2.4 核心反应方程](#2.4 核心反应方程)
- [2.5 盐桥(隔膜)的作用](#2.5 盐桥(隔膜)的作用)
- [3. 电池的输出电压与容量](#3. 电池的输出电压与容量)
-
- [3.1 电池的输出电压](#3.1 电池的输出电压)
- [3.2 电池的容量](#3.2 电池的容量)
- [3.3 电池的串联](#3.3 电池的串联)
- [3.4 电池的并联](#3.4 电池的并联)
1. 电池
电池是一种直流电压源,其将化学能直接转化为电能。
所有的电池都设计一种特殊的化学反应,为 氧化还原反应(在前面【化学基础】一篇中详细介绍过)。
在此反应中,电子从一种化合物转移到另一种化合物。将这两种化合物分离,并用导体连接起来形成闭合回路,就有可能使电子在电池外部的电路中移动,产生电流。与此同时,电池内部由于离子运动也将产生电流,这个电流与外部电流相等。
离子通过电池中的导电溶液(电解质)进行运动,只要电池外部也存在可供电子运动的路径,反应就能进行。将存储的化学能转化为电能。如果路径被破坏,反应就会停止,电池就处于平衡状态。
在电池中,发生氧化反应、向外电路提供电子的电极称为 负极 ;发生还原反应、从外电路获得电子的电极称为 正极。在放电状态下,负极的电势较低,正极的电势较高。
2. "铜锌电池单元"示例
1836年,英国化学家约翰·丹尼尔(John Daniell)发明了铜锌电池,解决了早期伏打电池自放电的严重问题。因此也将 铜锌电池 称为 丹尼尔电池(Daniell cell)。
2.1 构造
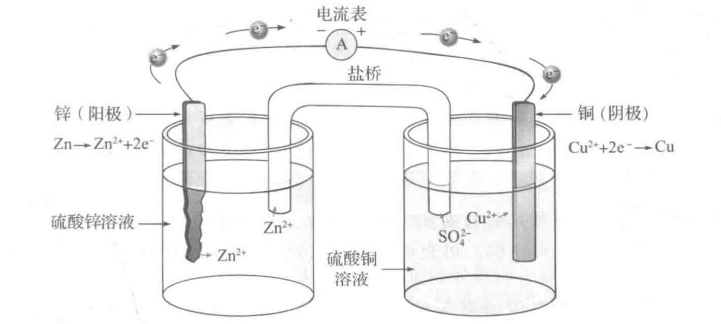
下图为不可充电的铜锌电池单元。
-
负电极:锌电极浸泡在硫酸锌(ZnSO₄)溶液中。
-
正电极:铜电极浸泡在硫酸铜(CuSO₄)溶液中。
-
电解质:硫酸铜和硫酸锌溶液,阻断了电子直接传递。硫酸铜和硫酸锌溶液被隔开,并用盐桥连接。
-
盐桥(或隔膜):通常装有氯化钾(KCL)饱和溶液的琼脂。允许 离子迁移。
-
外电路(回路):由电流表将锌和铜连接起来,形成闭合回路。
2.2 发生的化学反应
-
负极(锌):发生氧化反应,锌失去电子溶解为锌离子(锌比铜更为活泼,更易失电子)。
Z n → Z n 2 + + 2 e − Zn →Zn^{2+}+2e^- Zn→Zn2++2e− -
正极(铜):发生还原反应,铜离子得电子析出铜。
C u 2 + + 2 e 2 → C u Cu^{2+}+2e^2→Cu Cu2++2e2→Cu -
总反应
Z n + C u 2 + → Z n 2 + + C u Zn+Cu^{2+}→Zn^{2+}+Cu Zn+Cu2+→Zn2++Cu
2.3 电池原理
根据上面的氧化反应和还原反应可知,负极的锌原子失去电子,并将产生的电子通过外电路(电流表)流入正极,流入正极的电子与铜离子反应析出铜。
由此通过 电子定向移动将化学能→电能(放电)或电能→化学能(充电) ,这就是 电池原理。
2.4 核心反应方程
放电 (输出电能,氧化反应)
氧化剂 + 还原剂 → 氧化产物 + 还原产物 + 电能 氧化剂+还原剂→氧化产物+还原产物+电能 氧化剂+还原剂→氧化产物+还原产物+电能
充电 (输入电能,还原反应)
氧化产物 + 还原产物 + 电能 → 氧化剂 + 还原剂 氧化产物+还原产物+电能→氧化剂+还原剂 氧化产物+还原产物+电能→氧化剂+还原剂
2.5 盐桥(隔膜)的作用
盐桥是隔膜的一种。隔膜是一个广义概念,只要能实现 "分隔 + 离子传导" 的组件都可称为 隔膜 ;而 盐桥 是隔膜中一种结构和材料特定的类型(通常由琼脂 + 饱和电解质溶液组成)。盐桥主要用于小型实验原电池,成本低、易制备;隔膜主要用于长期稳定工作的电池,耐用性更强。
盐桥和所有类型的隔膜,本质都是为了解决原电池的核心矛盾 ------"既需要分隔两个半电池的反应物(避免直接反应浪费能量),又需要允许离子通过(维持电荷平衡,保证电流持续)"。因此,两者的核心功能完全相同:
(1)平衡半电池电荷,维持电中性(核心作用)
铜锌电池工作时,发生的氧化还原反应会使和正极的负电荷积累而形成"反向电场":负极的正电荷会阻碍 Zn²⁺继续进入溶液,正极的负电荷会阻碍 Cu²⁺ 继续得到电子,最终电子无法持续转移,电池很快停止工作。
而盐桥中的电解质(KCL)会解离出可自由移动的 K⁺ 和 Cl⁻,使 Cl⁻ 向负极移动, K⁺ 向正极移动,通过离子迁移维持电荷平衡。
(2)阻止电解质直接混合,避免"无效反应"
铜锌电池中,负极(Zn)若直接接触正极电解质(如 CuSO₄ 溶液),Zn 会直接与 Cu²⁺ 发生置换反应(Zn + Cu²⁺ = Zn²⁺ + Cu)------ 电子不经过外电路,直接在电极表面转移,无法产生电流(能量以热能浪费,而非电能)。
盐桥将两个半电池的电解质(如 ZnSO₄ 溶液和 CuSO₄ 溶液)隔开,仅允许离子通过(平衡电荷),但阻止两种电解质大量混合,避免了 Zn 与 Cu²⁺ 的直接反应,保证电子 "被迫" 通过外电路转移(产生电流)。
(3)减小液接电势(次要但重要的作用)
当两种不同电解质溶液接触时,界面处会因离子迁移速率不同产生电势差(液接电势),干扰电池电动势的稳定性。盐桥中通常使用 KCl(或 KNO₃),其中 K⁺和 Cl⁻的迁移速率接近相等,能最大限度抵消界面处的离子迁移差异,大幅减小液接电势,使电池电动势更稳定。
3. 电池的输出电压与容量
3.1 电池的输出电压
单个电池单元有一定的固定电压, 任何电池的电压都取决于电池的化学性质。在铜锌电池中,电压是1.1V。在汽车上使用的铅酸电池单元电压为 2.1 V。镍镉电池段元为 1.2 V,锂电池电压高到 4 V。
电池的化学特性也决定了电池的保质期和放电特性。例如锂二氧化锰电池的保质期通常是碳锌电池的 5 倍。
3.2 电池的容量
虽然电池的电压由其化学性质决定且固定,但其容量是可变的,取决于电池中反应物的数量。
(1)定义
电池的容量 指可以从电池中获得的电子数,并用一段时间内可以提供的电流来衡量。也可以说是电池在特定条件下可释放的总电荷量,即
Q = I × t Q = I×t Q=I×t
Q 为每小时释放的电荷量,I 为释放的电流,t 为小时数。
(2)单位
安时,Ah ,或 毫安时,mAh
3.3 电池的串联
电池通常由其内部多个具有电气连接的电池单元组成,电池单元的连接方式和电池的类型决定了电池的电压和电容容量。
为了增加电池电压,如果一个电池单元的正极与另一个电池单元的负极相连接,以此类推,电池总电压就是单个电池电压的总和,称为 电池的串联。如下图所示

3.4 电池的并联
为了增加电池的容量,如果几个电池单元的正极连接在一起,所有的负极也连接在一起,电池的总容量就是所有单个电池的容量总和,称为 电池的并联。
如果你觉得我的文章写的还不错,对你有帮助的话, "点赞 + 关注" 不迷路哦~