白蛋白结合型紫杉醇(nab-paclitaxel, nab-PTX)是一种临床广泛使用的化疗药物,在乳腺癌、肺癌、胰腺癌等多种实体瘤中显示出良好疗效。但其剂量限制性毒性之一是周围神经病变(CIPN),主要表现为机械痛觉过敏、冷痛觉异常和感觉迟钝,严重影响患者生活质量,甚至导致化疗中断。
α-硫辛酸作为一种经典抗氧化剂,已被广泛应用于糖尿病周围神经病变的治疗,也有研究提示其可能对化疗相关神经毒性具有一定保护作用,但其是否能够缓解 nab-PTX 诱导的周围神经病变,以及通过哪些关键通路发挥作用,仍缺乏明确证据。
今天这篇文章的重点在于探究:α-硫辛酸是否能够改善nab-PTX诱导的周围神经病变?其潜在分子机制是什么?
参考文献

研究思路
这篇文章的亮点在于研究思路设计
1.网络毒理学:解析 nab-PTX 导致周围神经损伤的潜在靶点和信号通路
2.网络药理学:预测 α-硫辛酸的作用靶点和保护机制
3.网络毒理学药理学整合分析:寻找"损伤机制"和"保护机制"的交集
4.分子对接:验证 LA 与关键靶蛋白的结合可能性
5.动物实验验证:通过动物实验和 ELISA 验证核心通路
这种"毒性机制 + 保护机制"双重筛选找到核心通路的分析是本文方法上的创新点
结果解读
Step1:α-硫辛酸改善 nab-PTX 诱导的痛觉异常
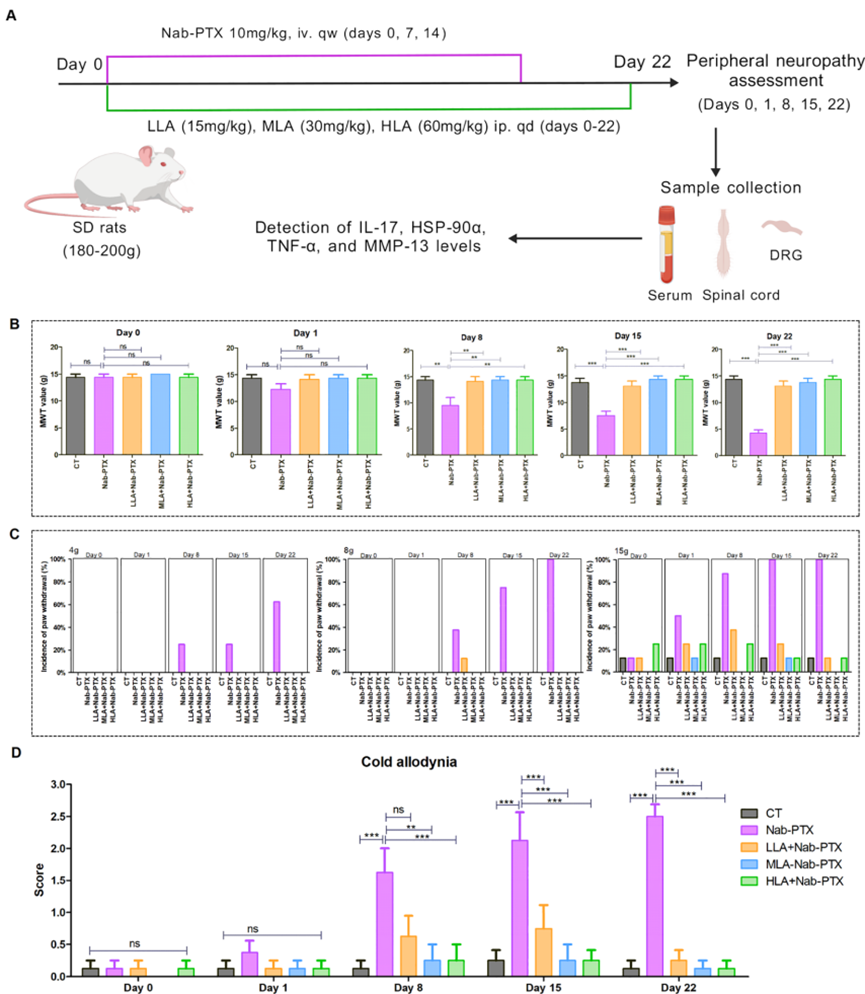
作者首先建立 nab-PTX 诱导的大鼠周围神经病变模型,并通过两种经典方法评估神经功能
结果显示:与对照组相比,nab-PTX 处理后大鼠的机械痛阈显著下降,冷痛觉评分显著升高,说明模型构建成功。在此基础上给予 α-硫辛酸干预,可明显提高机械痛阈、降低冷痛评分,且改善效果呈现剂量依赖性。证明nab-PTX 能稳定诱导外周神经功能障碍,α-硫辛酸在整体功能水平上对神经病变具有明确保护作用。这为后续机制研究提供了坚实的表型基础
Step2:网络毒理学揭示 nab-PTX 的致损伤机制
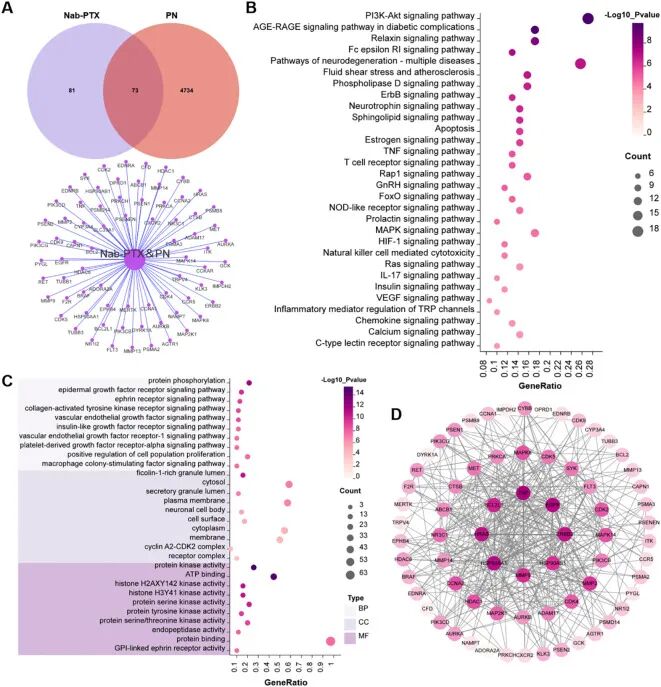
作者通过多个数据库预测 nab-PTX 相关毒性靶点,并与周围神经病变相关基因取交集,构建 PPI 网络并进行通路富集分析。
KEGG 结果显示,nab-PTX 相关靶点主要富集于炎症、氧化应激相关的PI3K-Akt、IL-17 、AGE-RAGE 等信号通路。
nab-PTX 诱导的周围神经病变并非单纯神经毒性,而是涉及免疫炎症反应与氧化应激的综合过程,IL-17 等免疫相关通路的出现,暗示该病变具有明显的"神经-免疫"为后续筛选关键通路提供了"毒性来源"
Step3:网络药理学揭示 α-硫辛酸的保护机制
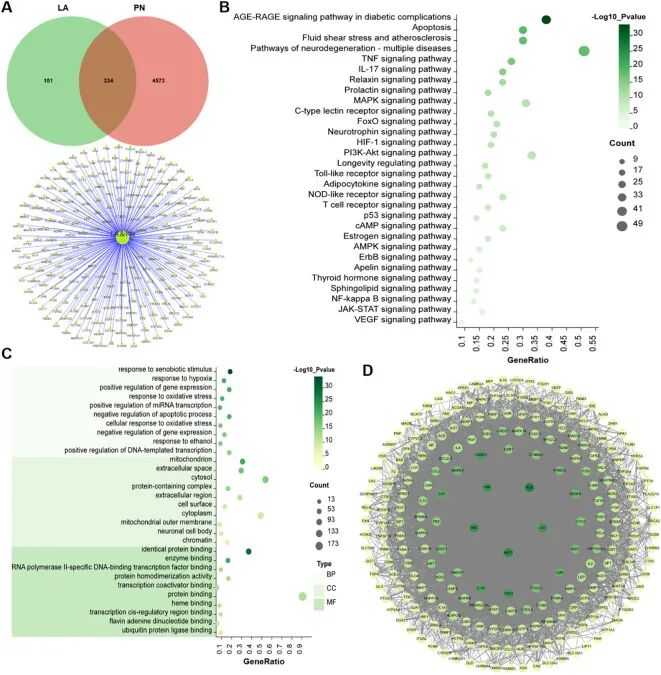
通过 SwissTargetPrediction、DrugBank 等数据库预测 α-硫辛酸的潜在作用靶点,并与周围神经病变相关基因进行交集分析。GO富集结果显示LA主要影响与外源性刺激反应、缺氧反应、基因表达的正向调节和氧化应激反应相关的生物过程。KEGG富集分析显示LA的保护作用主要通过AGE-RAGE信号通路、凋亡、流体剪切应激和动脉粥样硬化途径、TNF、IL-17等信号通路介导
这一结果说明α-硫辛酸并非单靶点药物,而是多通路调控,其作用方向与 nab-PTX 的致病机制高度吻合,且IL-17 信号通路,在毒性端和保护机制都被富集到
Step4:网络药理学、网络毒理学综合分析
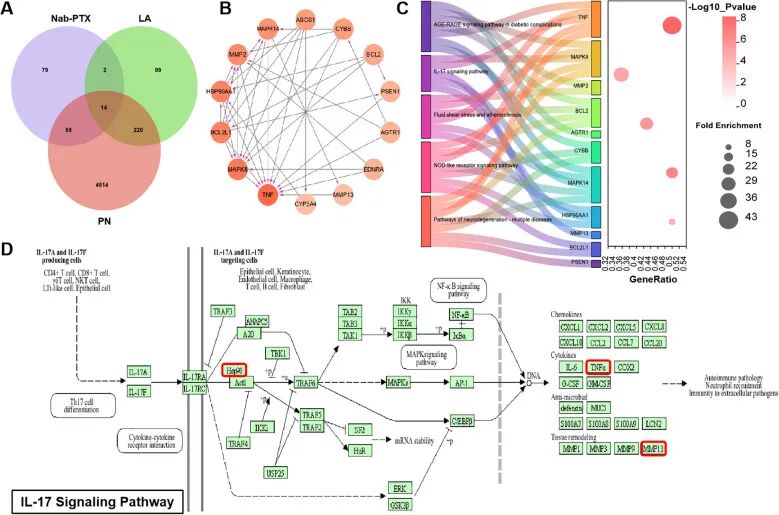
作者将nab-PTX 致病靶点、α-硫辛酸作用靶点、周围神经病变相关基因
进行交集,最终筛选出 14 个核心基因。
KEGG结果显示,这些基因主要集中于IL-17 、AGE-RAGE、TNF 等信号通路
IL-17 信号通路在"致病---干预---疾病"三重框架下反复被筛选,更说明其在 nab-PTX 诱导神经病变中可能是关键通路
Step5:分子对接验证结合稳定性
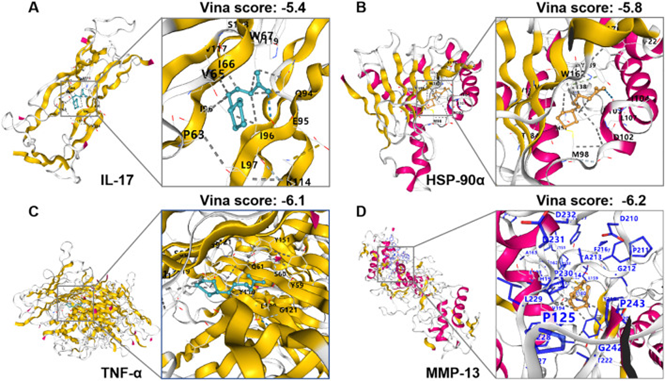
作者将α-硫辛酸与 IL-17 通路相关的关键蛋白(IL-17、TNF-α、HSP-90α、MMP-13)进行了分子对接。
结果显示:所有结合能评分均 < −5.0 kcal/mol,说明α-硫辛酸与这些靶蛋白具有较稳定的结合能力,在分子结构层面验证了 α-硫辛酸"可能直接调控 IL-17 通路"的假设,为后续动物实验提供了补充证据
总结
这篇文章通过网络药理学、网络毒理学,从毒性和保护两个方向共同去锁定了IL-17通路,在方法上具有一定创新性,思路完整,机制闭环清晰,具有一定临床转化潜力。