作者,Evil Genius
现在真的是走亲戚也没以前的味道了。
今天我们分享文献
知识积累
当肿瘤细胞组织成同型clusters,并与非恶性细胞形成特定关系时,其细胞状态的一致性达到最高;相比之下,随机分散的细胞则会下调其原始状态,获得替代表型,并表现出微环境的变化。
在发育过程中,细胞在群落中的组织遵循高度调控的空间模式,这些模式由同型相互作用和差异粘附机制维持。
以往癌症空间转录组学的研究侧重于肿瘤微环境(TME,异型相互作用)中恶性细胞与非恶性细胞之间的通讯,但忽略了恶性细胞自身的结构(同型相互作用)及其与功能的空间关系。
肿瘤细胞亚型排列成clusters和分散的空间模式,并且同型集群支持了肿瘤细胞的身份。相反,随机分散的GBM细胞表现出原始身份的丢失、向替代表型的转变以及获得与微环境不同的相互作用。
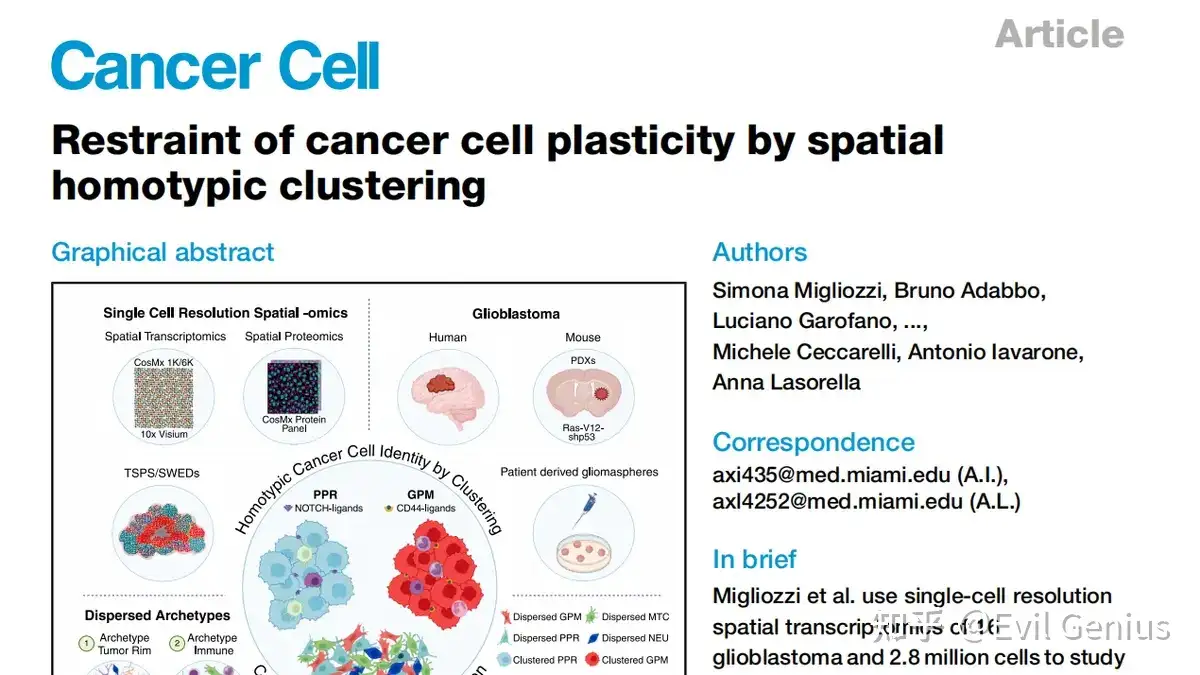
结果1、解析GBM的细胞状态和微环境
使用CosMx平台(包括1K和6K两个版本),这是两种能够对FFPE组织样本进行单细胞分辨率空间分析的技术。
区分恶性/非恶性细胞:基于GBM中高频发生的基因组 alterations(7号染色体扩增/获得和10号染色体缺失)的DNA拷贝数变异,将细胞区分为恶性细胞(约75%)和非恶性细胞(约25%)。
非恶性细胞注释:根据谱系特异性基因,将非恶性细胞分为胶质瘤相关髓系细胞(GAMs)、血管细胞(内皮细胞、周细胞)、T淋巴细胞、星形胶质细胞、神经元、少突胶质细胞及其前体细胞(OPCs)。其中,髓系细胞进一步细分为巨噬细胞、单核细胞、中性粒细胞、常规树突状细胞(cDC)和小胶质细胞。
恶性细胞状态分类
分类体系:基于前期通过单细胞转录组学定义的4种功能性细胞状态:
MTC(线粒体型):与线粒体代谢相关,临床预后较好。
GPM(糖酵解/多代谢型):与糖酵解等多代谢途径相关。
PPR(增殖/祖细胞型):与增殖和神经前体细胞程序相关。
NEU(分化神经元型):与神经元分化程序相关,在复发肿瘤中富集。
分类方法:采用单样本基因集富集分析(ssGSEA)结合标签传播算法,将高置信度的锚定细胞特征传播给其他未标记的恶性细胞。
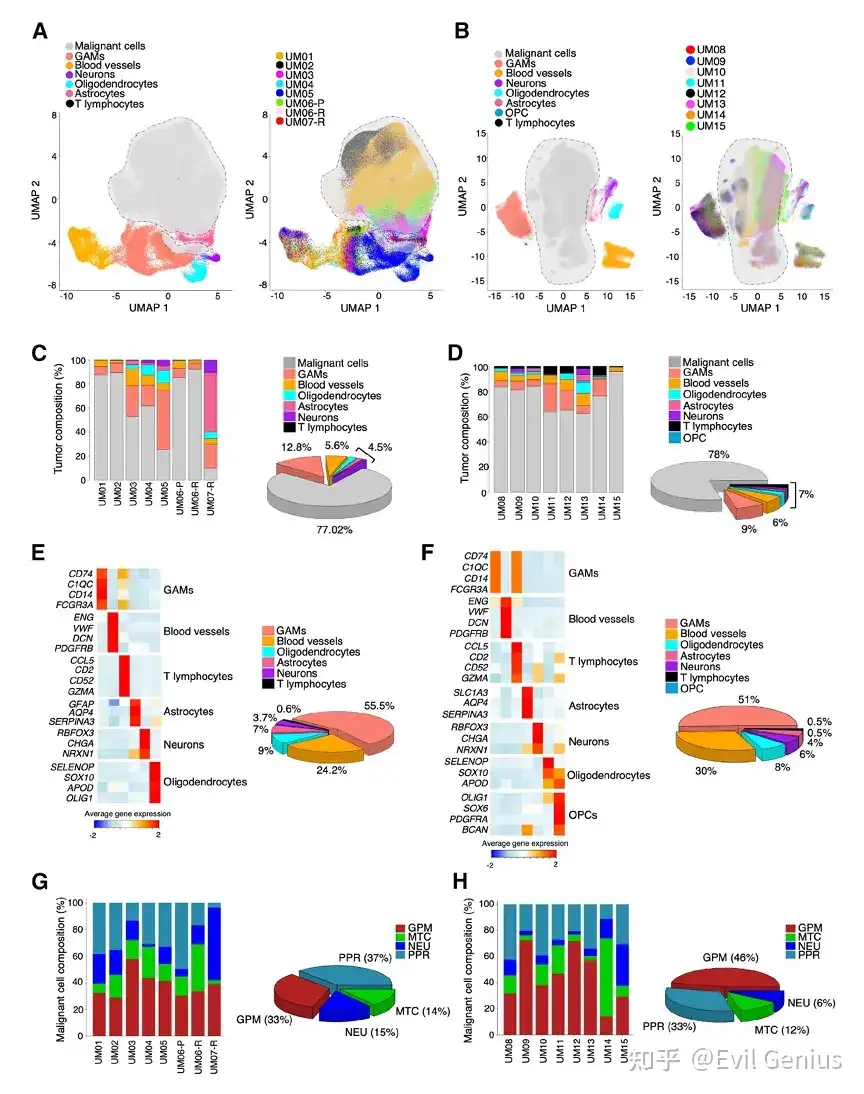
结果2、通过聚类和分散方法分析功能细胞状态的空间模式
GBM细胞状态具有特定的空间分布偏好
量化方法(TSPS):"肿瘤状态邻近评分",用于量化每种细胞类型的空间聚集程度。该评分反映了同一类型细胞在空间上相互靠近的趋势。
两种截然不同的空间模式:
高密度集群模式:GPM(糖酵解/多代谢型) 和 PPR(增殖/祖细胞型) 细胞具有高TSPS,表现为形成大而密集的细胞簇。这表明这两种状态倾向于聚集生长。
分散模式:NEU(分化神经元型) 和 MTC(线粒体型) 细胞具有低TSPS,倾向于分散分布,而不是形成紧密的集群。
空间模式与肿瘤解剖结构的关联
PPR集群:与"微血管增生"和"高细胞密度"区域显著相关,通常位于肿瘤核心区。
GPM集群:更常见于"坏死周围假栅栏区"。
GPM和PPR细胞倾向于形成集群,而NEU和MTC细胞倾向于分散。
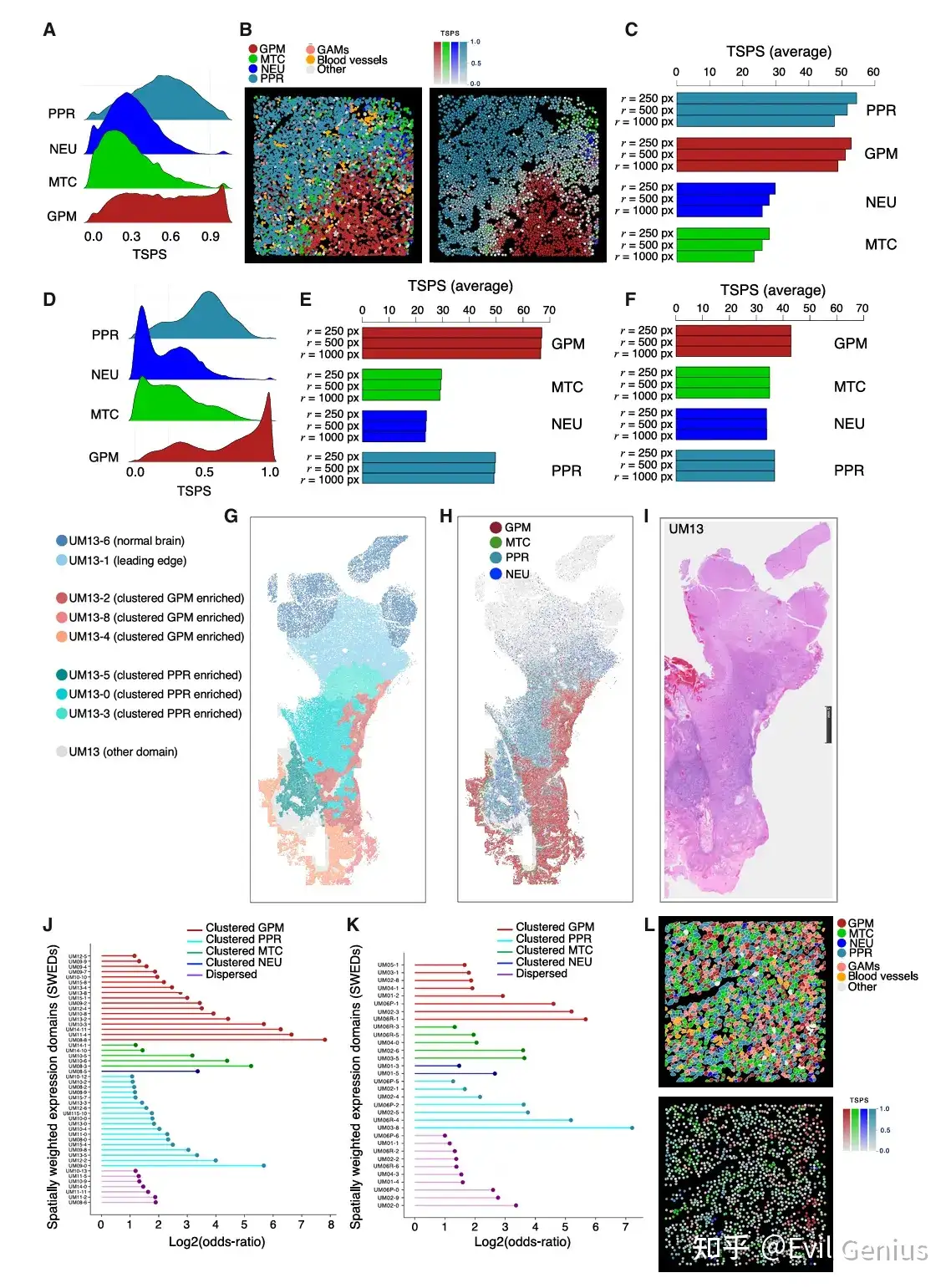
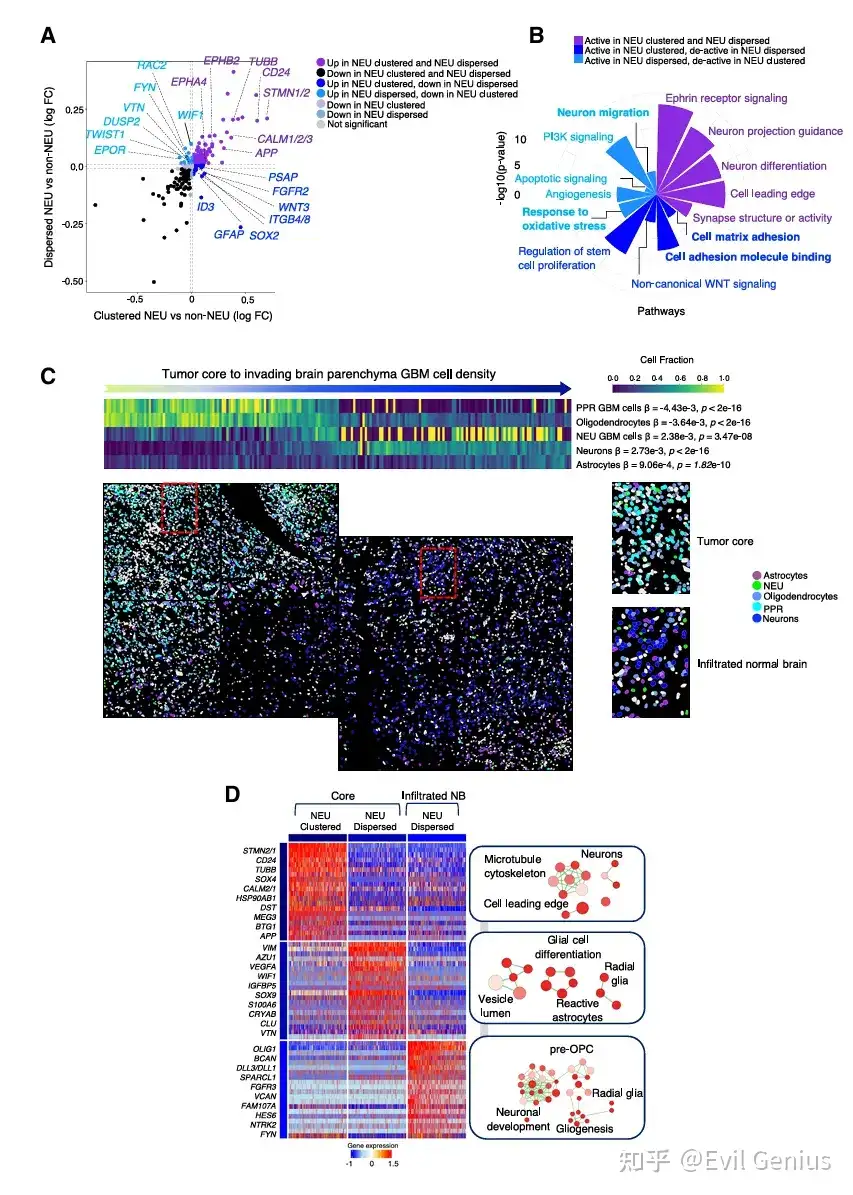
结果3、空间分布模式(集群 vs. 分散)如何直接影响GBM细胞的基因表达和功能特性。
细胞身份不仅由内在的亚型决定,更受到其所在空间环境的强烈塑造。
核心发现:空间模式改变细胞状态,集群维持"身份",分散导致"转变"
通过比较同一亚型但处于不同空间位置(集群 vs. 分散)的细胞,发现了系统性的分子差异:
GPM细胞:空间位置决定代谢与分化方向
集群GPM:根据所在病理区域不同,功能侧重点有异,但都维持了其核心代谢特性。
PAN(假栅栏区)集群:强烈表达缺氧应答基因。
非PAN集群:高表达活性氧应答及细胞外基质/粘附基因。
分散GPM:获得新的表型特征,上调星形胶质细胞生成和神经胶质谱系标记物,表明其偏离了原有状态,向胶质分化方向转变。同时,细胞外基质和粘附特性降低。
PPR细胞:集群维持增殖与干性
集群PPR:高表达细胞周期和干性相关基因,维持其作为增殖/祖细胞的核心功能。
分散PPR:这些核心特征减弱。
MTC细胞:分散导致代谢转换
集群MTC:富集线粒体相关基因,维持其氧化代谢特性。
分散MTC:上调通常由GPM细胞表达的基因,表明其代谢模式可能发生转换,同时线粒体生物合成和代谢活动减弱。
关键共性规律:细胞粘附与应激反应
集群细胞的共性标志:细胞粘附。无论哪种亚型,集群细胞都一致性地富集了细胞-细胞粘附相关的生物学过程。这表明粘附是维持集群结构和细胞原有身份的关键机制。
分散细胞的共性特征:应激与凋亡。所有分散细胞,无论其亚型,都共享了上调的凋亡信号和应激反应通路。这提示分散状态是一种不利的环境,细胞需要激活普遍的生存机制来应对压力。同时,分散细胞也展现出各自亚型特异性的新特征。
总结:空间位置是细胞命运的调节器
结论:同型集群通过激活细胞粘附,维持了GBM细胞的原有身份和核心功能。而细胞一旦分散,则会失去部分原有特征,获得新的亚型特异性功能,并共同激活应激反应。 这首次从功能层面证明,空间组织结构本身是限制癌细胞可塑性、防止其向更具侵袭性状态转变的重要机制。
结果4、从肿瘤核心到脑实质过渡区域的NEU胶质母细胞瘤细胞表型
NEU细胞是肿瘤侵袭前沿的动态群体,其表型随空间位置而改变
NEU细胞的共性特征与空间特异性差异
核心共性:无论集群还是分散,所有NEU细胞都稳定表达神经元核心标志物,维持其基本的神经元样特征。
空间特异性:
集群NEU:特异性上调细胞粘附分子和胶质祖细胞标志物,表明它们维持着一定的组织结构。
分散NEU:特异性激活生存应激基因和迁移程序,提示它们处于一种更具移动性和应激响应的状态。
NEU细胞在肿瘤-大脑界面的空间分布规律
肿瘤核心:主要由PPR细胞主导,NEU细胞占少数,其中一小部分形成集群,大部分与其他细胞混杂。
肿瘤边缘/浸润脑实质:NEU细胞显著富集,其比例随着与肿瘤核心距离的增加而上升,与神经元和星形胶质细胞共存。与此同时,PPR细胞的比例急剧下降。
空间微环境影响NEU细胞的表型转变
核心区的分散NEU:表现出星形胶质细胞/反应性星形胶质细胞相关的功能特征,表明它们获得了胶质分化倾向。
浸润脑实质的分散NEU:偏离了上述表型,转而趋向于一种更原始的祖细胞样状态。
总结:NEU细胞在侵袭前沿的可塑性
在肿瘤核心,NEU细胞维持着一定的神经元特性,但分散的NEU已开始向胶质方向偏离。
在肿瘤侵袭前沿,NEU细胞是主要的恶性细胞类型。它们在正常的神经胶质环境中浸润,并展现出一种独特的、介于神经元和祖细胞之间的可塑状态,这种状态可能更有利于它们在脑实质中生存和迁移,从而驱动肿瘤的侵袭和复发。这进一步证实了空间位置是塑造癌细胞命运的关键因素。
结果5、GBM实验模型中塑性行为的聚类机制与调控
同型集群由细胞粘附驱动,但不同细胞状态依赖不同的分子机制:GPM细胞依赖CD44介导的粘附,而PPR细胞依赖NOTCH信号。
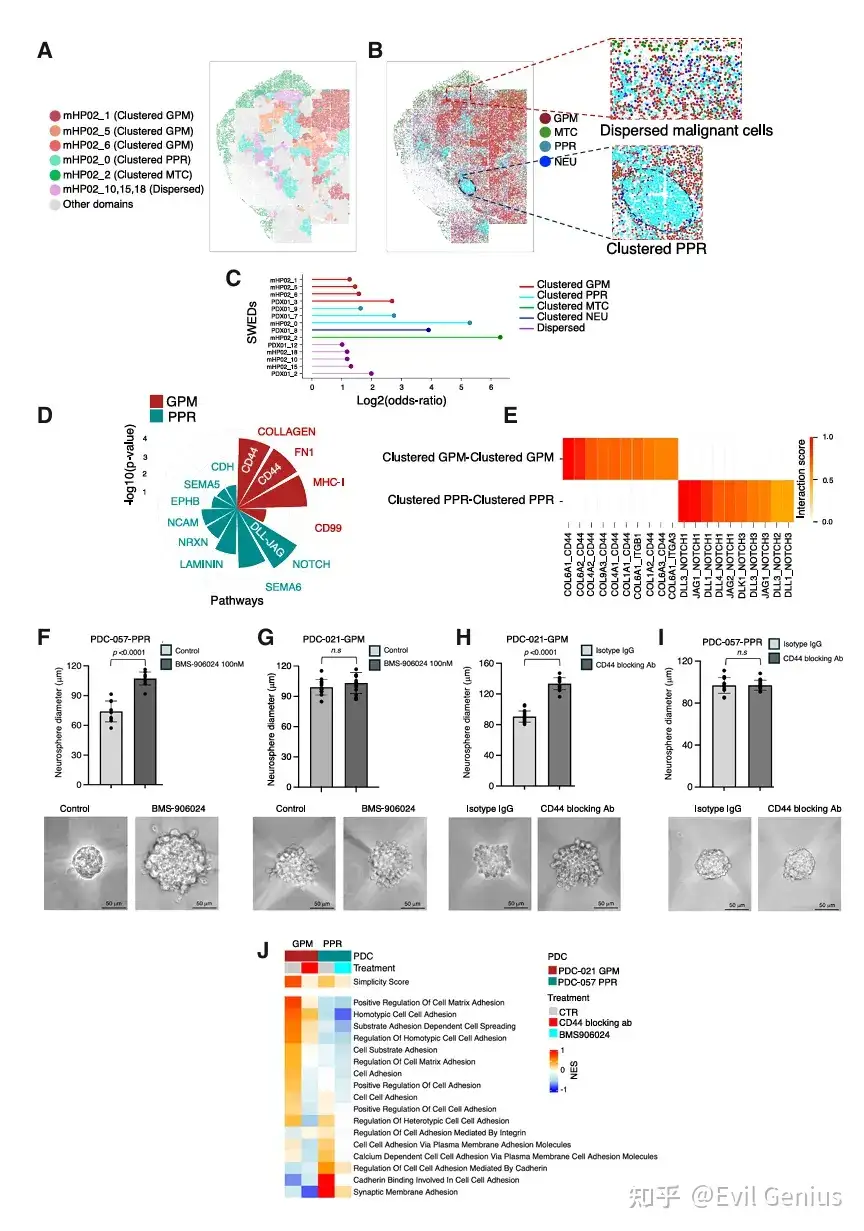
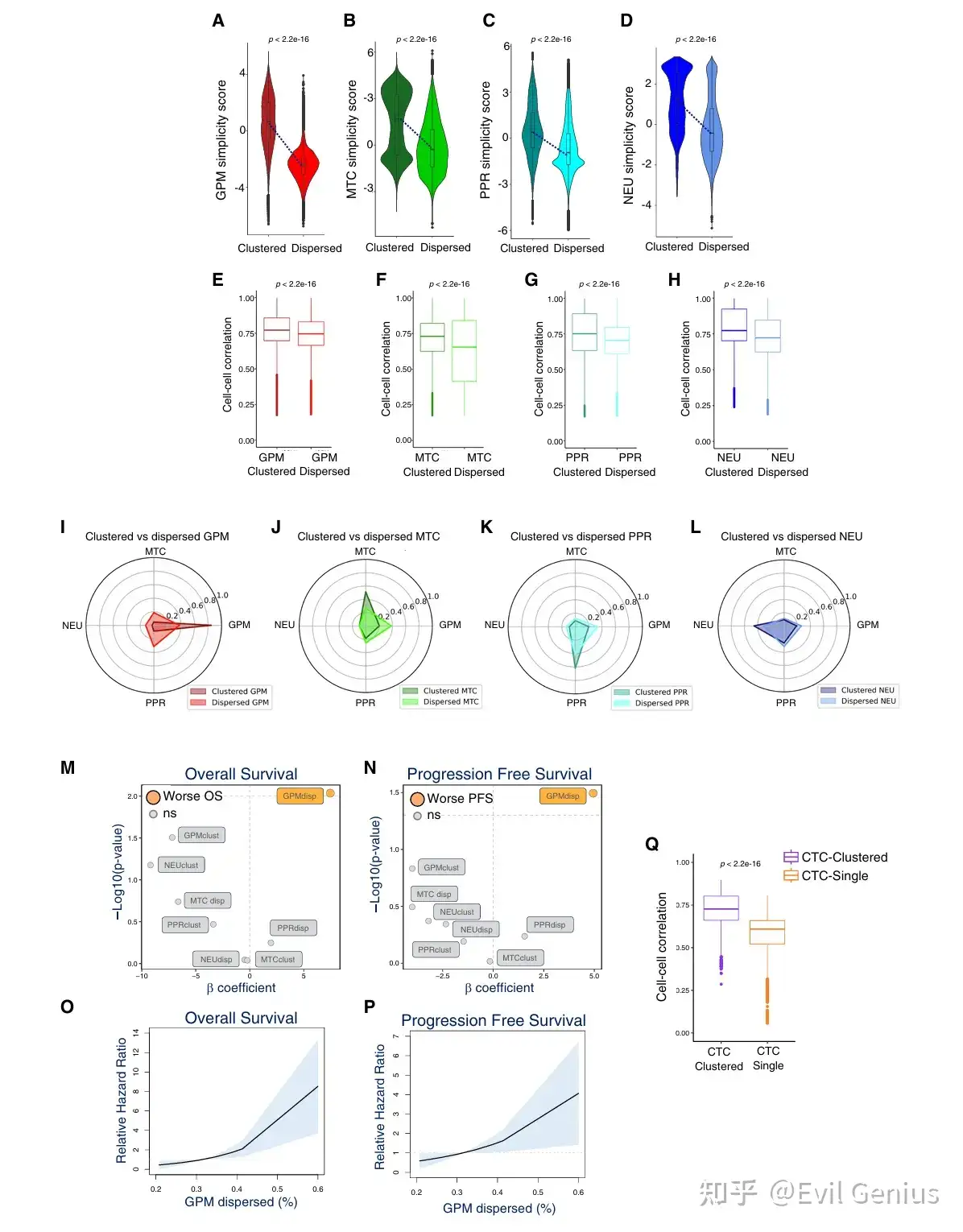
结果6、同型聚集体维持细胞身份,并且是一种防止肿瘤细胞可塑性的普遍机制。
同型集群是维持肿瘤细胞身份、限制可塑性的普遍机制,而细胞分散则导致身份丢失和异质性增加,其中GPM细胞的分散状态具有独特的临床预后意义。
机制层面:同型集群通过细胞粘附,强制维持了肿瘤细胞的"身份",限制了其向其他状态转变的可塑性。
功能层面:细胞一旦分散,就会进入一种不稳定的"混沌"状态,更容易发生表型转换,从而加剧肿瘤异质性。
临床层面:GPM细胞的分散状态是GBM患者预后不良的独立风险因素,突出了靶向特定亚型空间模式(如通过CD44)的潜在治疗价值。
普适性:这种"集群维持身份"的法则可能适用于包括乳腺癌在内的多种癌症。
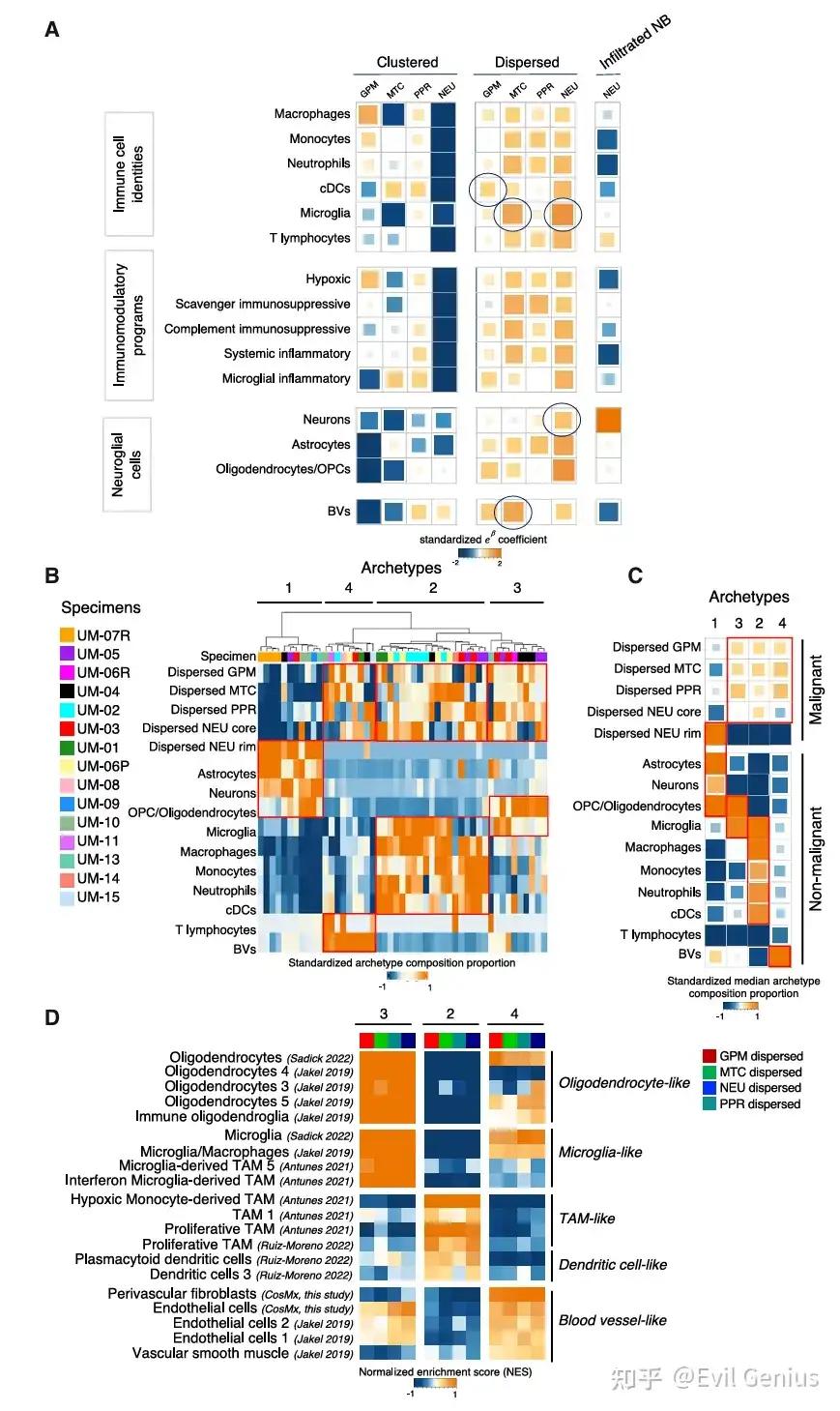
结果7、GBM肿瘤微环境的空间组织及其与GBM细胞亚型的相互作用
系统解析GBM细胞(特别是集群与分散状态)与肿瘤微环境中多种非恶性细胞(免疫细胞、神经胶质细胞、血管)的空间互作模式,并揭示了微环境对癌细胞表型的塑造作用(细胞拟态)。
不同状态的癌细胞招募或选择不同的微环境,形成特定的生态位(如GPM集群的免疫抑制缺氧区,PPR集群的血管相关区)。
分散状态本身重塑了TME,例如吸引了T细胞和神经胶质细胞浸润。
反过来,微环境通过"细胞拟态"机制,进一步赋予癌细胞新的表型特征,加剧了肿瘤的异质性和可塑性。
这强调了在理解肿瘤生物学和开发治疗策略时,必须将癌细胞与其空间微环境作为一个整体系统来考虑。
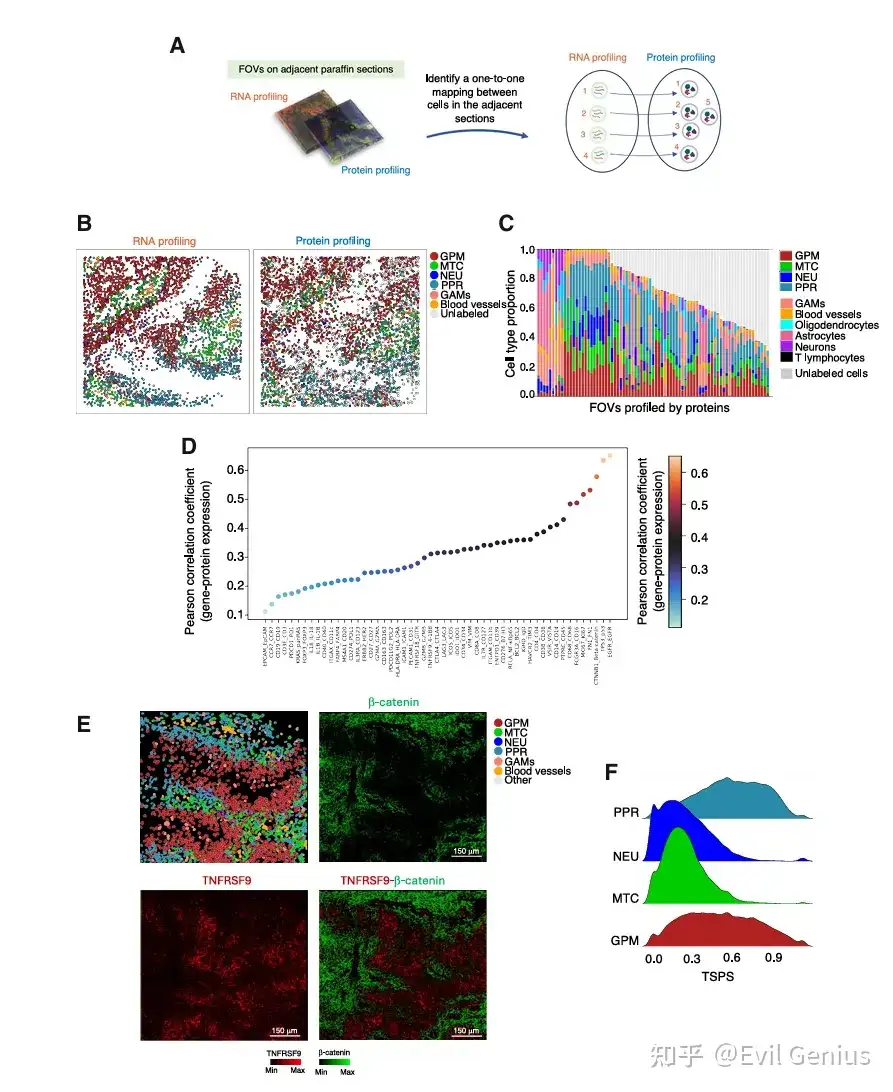
结果8、通过CosMx单细胞蛋白表达捕捉GBM亚型的空间模式
利用CosMx平台的空间蛋白质组学数据,验证并巩固了基于转录组学发现的GBM细胞空间分布模式及肿瘤-微环境互作规律。
最后来看看方法



